Introdução ao controle de corrosão, incrustação e bioincrustação em sistemas de resfriamento
O capítulo anterior descreveu os fundamentos do projeto/operação da torre de resfriamento e do trocador de calor. Neste capítulo, examinamos a química da água de resfriamento e os programas de tratamento para manter a confiabilidade em toda a rede de água de resfriamento.
Os sistemas de resfriamento exigem proteção contra corrosão, incrustação e incrustação biológica (ou incrustação microbiológica) para maximizar o desempenho. Uma representação simbólica dessas questões e sua interdependência é mostrada abaixo.

Corrosão, incrustação e controle de bioincrustação devem ser considerados de maneira holística. Um quarto fator cada vez mais importante é o impacto ambiental potencial da química do tratamento de água, especialmente em relação a produtos químicos que poderiam aparecer na descarga da planta. Os programas de tratamento que antes eram comuns podem não ser mais permitidos ou podem ser gravemente restritos devido às regulamentações de alta.
Embora os métodos de tratamento muitas vezes tenham várias funções, um aspecto fundamental é a proteção das superfícies metálicas. Nas próximas seções, analisamos os mecanismos de corrosão e métodos de controle mais comuns.
Índice
Uma breve revisão da metalurgia do sistema de resfriamento e da composição dos materiais
Mecanismos de corrosão de metal primário
Tipos de corrosão
Mecanismos de Deposição
Formação de escala
Controle de Deposição e Corrosão
Controle de corrosão
Química de filmagem
Controle de corrosão da água de resfriamento fechada (CCW)
Controle de corrosão por meio de seleção de materiais e eletroquímica
Preocupações microbiológicas
Controle microbiológico
Biocidas oxidantes e não oxidantes
Limpeza e sanitização de agentes microbiológicos poluentes
Métodos de controle de macroincrustação
Métodos de monitoramento microbiológico
Monitoramento de biocidas oxidantes
Monitoramento de alimentação química, deposição e corrosão
Limpeza e Passivação do Sistema de Resfriamento
Conclusão
Uma breve revisão da metalurgia do sistema de resfriamento e da composição dos materiais
Como uma revisão rápida, o material típico para a tubulação do sistema de resfriamento e muitas carcaças do trocador de calor (HX) é aço carbono suave. Os tubos ou placas HX podem ser de aço inoxidável, ligas de cobre, titânio, alumínio ou, em alguns casos, ligas resistentes à corrosão caras. Fixadores de aço galvanizado estão frequentemente presentes em torres de resfriamento, enquanto torres menores podem ser predominantemente galvanizadas. A maioria das grandes torres de resfriamento tem bacias de concreto e algumas ainda têm componentes estruturais de madeira. Assim, o sistema de resfriamento completo pode compreender uma variedade de materiais, onde o conhecimento de todos é essencial para a seleção de programas confiáveis de controle de corrosão.
Mecanismos de corrosão de metal primário
A corrosão do metal é um processo eletroquímico no qual os metais em um estado refinado revertem à sua forma natural. O ferro é o exemplo clássico. De acordo com a referência 1, "Os depósitos de minério de ferro mais importantes da Terra são encontrados em rochas sedimentares. Eles se formaram a partir de reações químicas que combinavam ferro e oxigênio em águas marinhas e doce. Os dois minerais mais importantes nesses depósitos são os óxidos de ferro hematita (Fe2O3) e magnetita (Fe3O4). Esses minérios de metal foram extraídos para produzir quase todos os objetos de ferro e aço que usamos hoje." Materiais à base de ferro e outros metais, quando colocados em serviço, podem ser atacados de várias maneiras. O mais observável é a reação de ferro ou aço neutro com água e oxigênio para produzir ferrugem, mas outros mecanismos de corrosão são comuns. Os mais prevalentes incluem:
- Corrosão geral ou uniforme
- Torção
- Corrosão da cravo
- Corrosão por erosão
- Corrosão microbiologicamente influenciada
- Rachadura por corrosão sob tensão, fadiga por corrosão e corrosão intergranular
- Corrosão galvânica
- Lixiviação ou desligamento seletivo
O controle adequado de corrosão é necessário para prolongar a vida útil do equipamento; minimizar o transporte de produtos de corrosão para outros locais; e, às vezes, para garantir a segurança dos funcionários.
Célula de corrosão
A força motriz para reações corrosivas é o potencial elétrico entre o receptor de elétrons (o meio corrosivo) e o doador de elétrons (o metal). O exemplo a seguir ilustra o processo fundamental de corrosão. É o simples experimento laboratorial de imersão de uma barra de ferro em uma solução de ácido clorídrico (HCl). Quase imediatamente, bolhas aparecerão ao longo da superfície submersa da barra e, em um tempo relativamente curto, a corrosão se tornará totalmente visível. A Figura 7.2 resume a química.
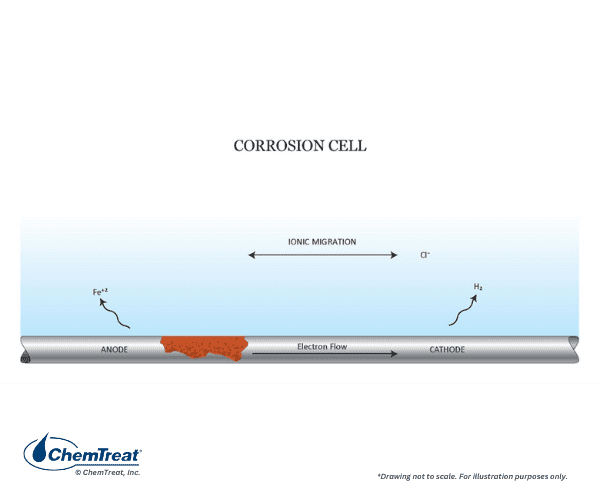
Três reações explicam o processo geral:
- Cada átomo de ferro em um local de corrosão libera dois elétrons (oxida) e, assim, se transforma de um estado de oxidação zero para um estado de oxidação +2, Fe0 → Fe2+ + 2e– (Eq. 7-1). Os íons Fe2+ (ferrosos) migram para a solução. Esses locais são conhecidos como ânodos.
- Os elétrons liberados nos ânodos fluem através do metal para outros locais onde reagem com os íons de hidrogênio (redução) do ácido para produzir gás hidrogênio, 2H + + 2e– → H2↑ (Eq. 7-2). A redução ocorre nos cátodos.
- Íons de cloreto (Cl–) e íons ferrosos migram através da solução para produzir cloreto ferroso solvatado (FeCl2) e completar o circuito elétrico.
Neste caso em particular, ânodos e cátodos formam-se ao longo da superfície metálica. Muitas bolhas de hidrogênio se formam imediatamente e, logo depois, a corrosão visível aparece em toda a barra. Este é um exemplo de corrosão geral, onde os ânodos e cátodos mudam constantemente, e também é um exemplo clássico de uma reação de oxidação-redução ou “redox”.
Cada metal exibe uma tendência diferente para liberar ou aceitar elétrons e, como será mostrado em breve, o agente corrosivo tem uma grande influência. A lista de potenciais de meia célula de metal em comparação com o potencial de meia célula de hidrogênio é útil e instrutiva.
2H ++ 2e– - H2↑ E0 = 0,00 V para uma solução molar 1 por definição
A tabela a seguir destaca os potenciais de vários dos metais mais comuns.
Tabela 7-1. Potencial de meia célula para metais bem conhecidos em comparação com a meia célula de hidrogênio
| Reação de eletrodos | Potencial do eletrodo padrão (V 0) |
| Mg → Mg2+ + 2e– | 2,363 |
| Al → Al3+ + 3e– | 1,662 |
| Zn → Zn2+ + 2e– | 0,763 |
| Fe → Fe2+ + 2e– | 0,440 |
| H2 → 2H + + 2e– | 0,000 |
| Cu → Cu2+ + 2e– | -0,340 |
| Ag → Ag+ + e– | -0,800 |
| Au → Au3+ + 3e– | -1,420 |
A partir dessa tabela, podemos derivar diversos conceitos importantes.
- Os metais acima do hidrogênio na mesa serão todos corroídos em ácido.
- Considere novamente a reação mostrada na Figura 7.2. A tabela indica que o ferro tem um potencial de reação significativo quando comparado ao ácido.
- O cobre (e tipicamente suas ligas) estão no lado “nobre” do potencial de meia célula de hidrogênio, o que significa que ele permanece estável em ácidos minerais comuns. Agentes oxidantes são normalmente necessários para corrosão.
- Prata e ouro são dois dos metais verdadeiramente nobres. Especialmente para ouro, soluções especiais, por exemplo, aqua regia, são necessárias para dissolver o metal.
- Esses dados também são importantes para determinar a probabilidade de corrosão galvânica quando dois metais diferentes são acoplados em um ambiente de água. A corrosão galvânica é examinada em mais detalhes posteriormente.
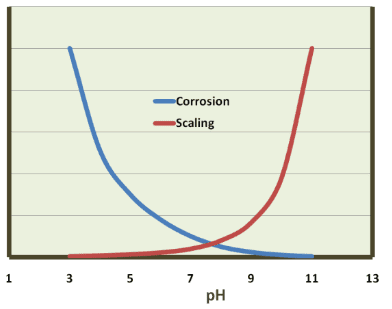
Com relação ao material estrutural comum de muitos sistemas de água de resfriamento, a estria suave, Figura 7.3 ilustra a influência do pH, isto é, a concentração de íons de hidrogênio.
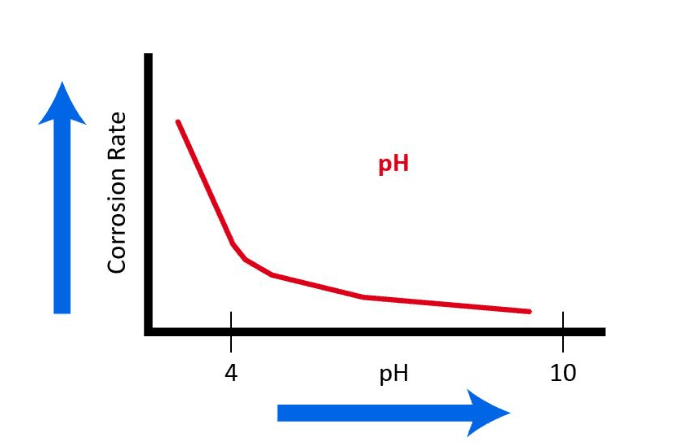
Consequentemente, a maioria dos programas modernos de química do sistema de resfriamento opera dentro de uma faixa de pH superior a 7 a 8. Nessas condições, uma camada fina e passiva de CaCO3 pode se formar para inibir ainda mais a corrosão. No entanto, como foi brevemente discutido no Capítulo 6 e será reexaminado posteriormente neste capítulo, a formação de incrustação de carbonato de cálcio pode ser um dos problemas mais problemáticos nos sistemas de resfriamento.
Se o ácido fosse o único corroente em um sistema de água de resfriamento, o controle de corrosão seria simples. Infelizmente, várias outras reações catódicas são possíveis, com a mais prevalente sendo a redução de oxigênio em soluções neutras ou alcalinas.
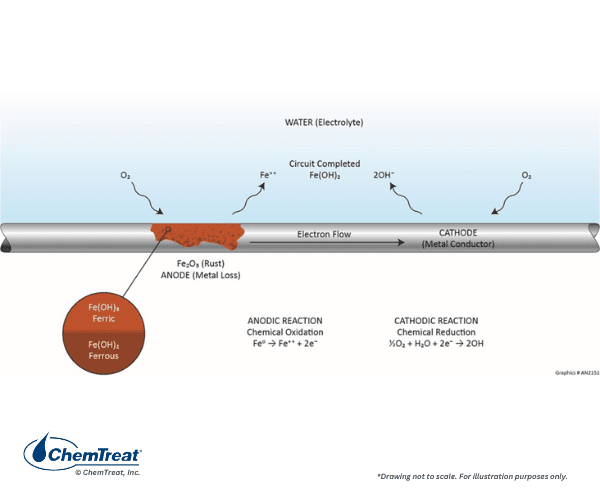
A reação anódica é a mesma mostrada anteriormente.
- Fe0 → Fe2+ + 2e‒ | Eq. 7-1
O oxigênio é reduzido no cátodo:
- ½O2 + H2O + 2e‒→ 2OH ‒ | Eq. 7-3
Os íons de hidróxido se combinam com Fe2+ para formar hidróxido ferroso:
- Fe2+ + 2OH ‒→ Fe(OH)2 | Eq. 7-4
No ambiente carregado de oxigênio, ocorrem reações adicionais. Primeiro, o hidróxido ferroso continuará a reagir com oxigênio para formar hidróxido férrico:
- 2Fe (OH)2 + ½O2 + H2O → 2Fe (OH)3↓ | Eq. 7-5
Os reagentes mostrados nas Equações 7-4 e 7-5 estão em equilíbrio com outras espécies de óxido de ferro, conforme mostrado abaixo:
- Fe(OH)2 -- FeO + H2O | Eq. 7-6
- Fe(OH)3 - (OH) + H2O | Eq. 7-7
Eventualmente, esses produtos se desidratam e se transformam em ferrugem, que é marrom e não oferece proteção ao metal subjacente:
- 2FeO (OH) - Fe2O3↓ + H2O | Eq. 7-8
Dois outros aspectos importantes a considerar são que, no processo eletroquímico, as reações catódicas ditam a taxa de corrosão, enquanto as reações anódicas ditam o tipo de corrosão. Como será descrito em mais detalhes, situações podem surgir com um pequeno número de ânodos fixos em um grande ambiente catódico. Essa combinação pode levar a corrosão localizada grave e falhas potencialmente rápidas.
O leitor observará que magnésio e alumínio estão no topo da Tabela 7.1 e perguntará por que esses materiais são usados para muitos fins de infraestrutura, como algumas peças de avião, componentes elétricos, latas de bebidas e assim por diante. Os elementos são tão reativos que, durante o processo de produção, uma camada de óxido estanque se forma na superfície do metal e protege o metal base contra corrosão adicional. Somente ácidos ou álcalis fortes atacarão essa camada protetora, portanto, durante o serviço normal, os metais permanecem bastante estáveis.
Vários outros fatores importantes influenciam a maioria dos mecanismos de corrosão. Eles estão descritos abaixo.
Condutividade
A corrosão é um processo eletroquímico e, à medida que a concentração de sólidos dissolvidos aumenta, a condutividade e a taxa de corrosão correspondentes também aumentam.
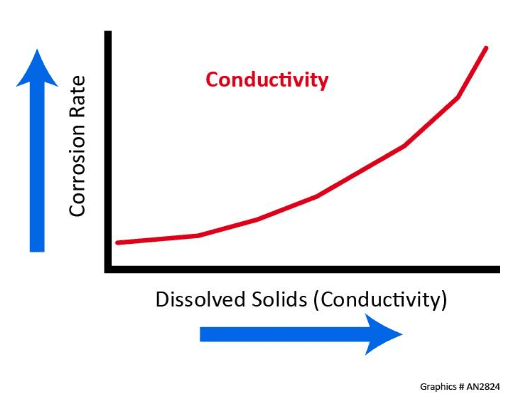
Considere resfriar a água em um sistema de recirculação aberto que tenha uma condutividade de 2.750 μS/cm e compare esse valor com a água pura com uma condutividade teórica de 0,055 μS/cm. A água de resfriamento é 50.000 vezes mais condutora do que a água pura.
Temperatura e concentração de oxigênio dissolvido
A temperatura geralmente tem um impacto significativo na taxa de corrosão, e uma regra geral sugere que a taxa dobra a cada aumento de 10 °C (18 °F) na temperatura do fluido. Além disso, a taxa de corrosão, em geral, dobrará a cada aumento de 10–20°F na temperatura da pele de metal. Alguns processos podem produzir tanto calor que o gás oxigênio molecular pode se formar sob depósitos, influenciando exponencialmente o processo de corrosão. O efeito da temperatura e da concentração de oxigênio nas taxas de corrosão é mostrado abaixo.
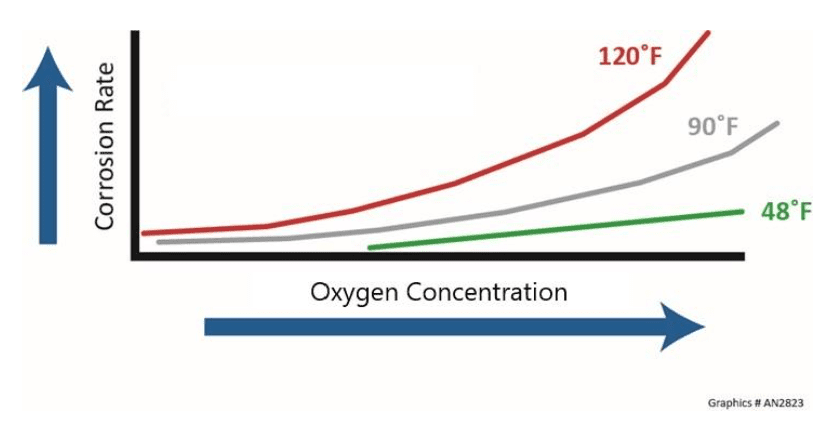
Considere resfriar a água em um sistema de recirculação aberto que tenha uma condutividade de 2.750 μS/cm e compare esse valor com a água pura com uma condutividade teórica de 0,055 μS/cm. A água de resfriamento é 50.000 vezes mais condutora do que a água pura.
Velocidade da água
A velocidade alta e baixa do fluido pode ser problemática em relação à corrosão. Altas velocidades podem varrer os produtos de corrosão (que às vezes protegem o metal subjacente), promovendo mais corrosão. Velocidades excessivas também podem induzir erosão-corrosão, como será descrito mais adiante nesta seção. Por outro lado, condições de baixo fluxo ou estagnação podem potencialmente aumentar a corrosão, pois isso pode manter íons corrosivos em contato de longo prazo com o metal. Uma diretriz comum para a taxa de fluxo linear através de tubos de tubulação e trocadores de calor é de 5 a 10 pés por segundo (qps), o que fornece um equilíbrio entre o controle de corrosão/deposição e os custos de material. No entanto, cada projeto requer uma análise cuidadosa para otimizar o projeto e as taxas de fluxo de tubulações e equipamentos. Por exemplo, se por algum motivo um metal macio for necessário para uma aplicação, uma taxa de fluxo mais baixa pode ser necessária para minimizar a erosão.

REFINARIA MELHORA O CONTROLE DE CORROSÃO E REDUZ OS CUSTOS OPERACIONAIS COM O FLEXCORR.
Tipos de corrosão
Agora examinaremos os tipos mais comuns de corrosão em sistemas de refrigeração. Algumas, como a corrosão geral, muitas vezes permitem uma longa vida útil do material e podem ser controladas com tratamentos diretos. Outros, como a corrosão alveolar, são conhecidos por causar penetrações através da parede de tubos e outros equipamentos dentro de meses e, às vezes, até semanas. Desligamentos caros da unidade e substituição de material podem ser o resultado.
Corrosão geral
Com a corrosão geral, os ânodos e cátodos no metal mudam constantemente, e os locais de corrosão localizados não se desenvolvem. A vida útil do metal pode ser bastante longa quando a corrosão geral é o único problema. As figuras abaixo ilustram dois exemplos de corrosão geral.

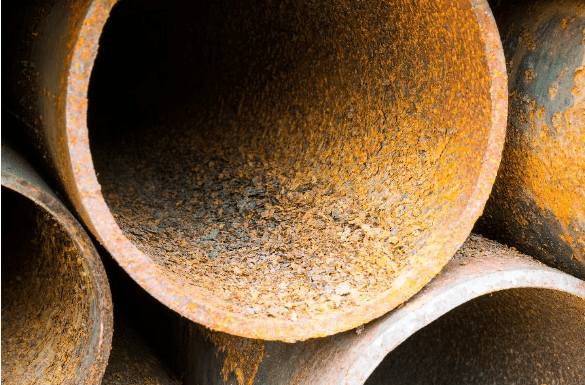
A seleção de materiais e dimensões, como espessura da parede do tubo, geralmente são baseadas em uma expectativa de vida útil de 30 anos por cálculos gerais de corrosão. Por exemplo, considere um tubo de 6 pol. de diâmetro, de escala 40, com uma espessura de parede de 0,28 pol. Quando aproximadamente 50% da parede do tubo estiver corroída, o tubo pode estar próximo de falhar e deve ser reparado ou substituído. A unidade comum para a taxa de corrosão é de mils por ano (MPY), onde um mil é um milésimo de polegada. Neste exemplo, uma taxa de corrosão geral e não razoável de 4,67 MPY resultaria em 50% de perda de parede após 30 anos. Bons programas de controle de corrosão minimizarão a corrosão geral, mas como as próximas subseções descrevem, a corrosão localizada pode ser muito destrutiva e pode ser influenciada por uma variedade de fatores.
Corrosão por corrosão alveolar
Se a corrosão se tornar localizada, ânodos permanentes se desenvolverão em um ambiente catódico de grande porte. O resultado, como mostrado abaixo, é a formação de uma punção, ou mecanismos semelhantes que devemos observar.

A taxa de corrosão pode ser a mesma que a corrosão geral, mas os danos são muito mais graves devido à rápida penetração do metal nos ânodos. Inúmeros mecanismos ou condições podem iniciar a corrosão alveolar. Os depósitos de sólidos no aço podem produzir áreas com escassez de oxigênio. Esses pontos são anódicos ao aço limpo. Colônias microbiológicas podem fazer o mesmo e também podem liberar compostos corrosivos por meio de processos metabólicos. Exploraremos esse fenômeno um pouco mais tarde. Técnicas de soldagem ruins podem alterar a composição química do metal no local da solda e aumentar a suscetibilidade à corrosão.
Um fenômeno comum com o aço carbono é o acúmulo do produto de corrosão (ferrugem) sobre o poço.
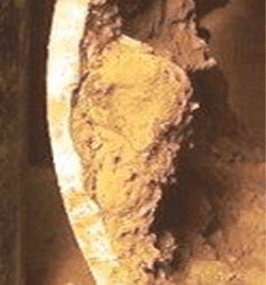
O líquido preso por baixo pode sofrer reações que aumentam a acidez, o que aumenta o potencial de corrosão.
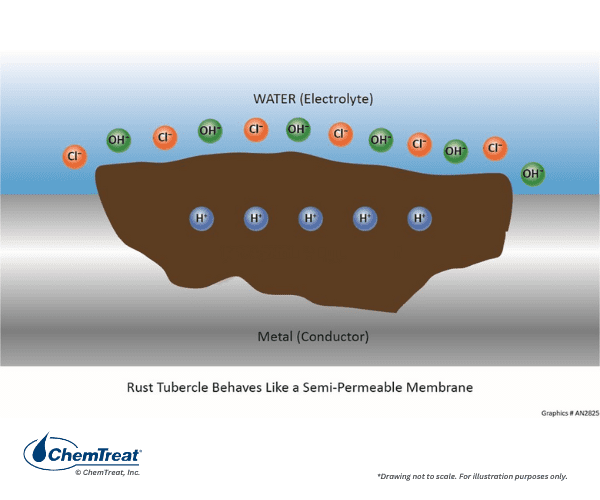
Cloretos ou outros ânions difundem-se no poço para tentar manter a neutralidade da carga, no entanto, as condições ácidas muitas vezes permanecem. Os depósitos acima do poço impedem que os inibidores de corrosão da água a granel repassem a superfície metálica dentro do poço.
As figuras a seguir ilustram exemplos adicionais de corrosão alveolar.



7.11a é a corrosão que penetrou a bacia de metal de uma torre de resfriamento. 7.11b mostra produtos de corrosão na parte externa de um tubo que foi gerado por ataque interno e resultante penetração através da parede. 7.11c ilustra outra penetração através da parede.
Para poços de aço carbono cobertos ou preenchidos com produtos de corrosão, se o material for preto (normalmente devido à presença de magnetita (Fe3O4)), o poço está ativo e o processo de corrosão está em andamento.
A corrosão por cloreto de aços inoxidáveis é um problema frequente, inclusive em sistemas de recirculação abertos onde a evaporação da torre de resfriamento (consulte o Capítulo 6) aumenta a concentração de sólidos dissolvidos. Os dois aços inoxidáveis (SS) mais populares para tubos condensadores de superfície a vapor são 304 e 316, e muitas vezes um ou outro é especificado para um projeto sem que os projetistas pensem muito, se houver, nas concentrações de cloreto que os materiais verão. A dificuldade é que os aços inoxidáveis formam um revestimento de óxido que protege o metal base, mas o cloreto em concentração suficiente penetrará na camada de óxido e iniciará a corrosão. Durante anos, os níveis máximos de cloreto recomendados para esses aços variaram de 500 ppm para 304 SS a 3.000 ppm para 316L SS em temperatura ambiente. Posteriormente, pesquisas mostraram que esses limites eram muito altos, e um especialista em materiais observado sugere 100 e 400 ppm, respectivamente, para tubos limpos. Observe a ênfase em tubos limpos. Os depósitos exacerbam o potencial de corrosão. Além disso, temperaturas acima do ambiente influenciam muito o potencial de rachaduras por corrosão sob tensão induzidas por cloreto (SCC) de aços inoxidáveis austeníticos, o que pode ser uma grande preocupação em indústrias como o refino de petróleo, que têm muitos trocadores de calor para a produção de vários compostos. O SCC é examinado em breve.
A resistência à corrosão por cloreto é frequentemente um fator principal na seleção de materiais do trocador de calor. Um guia bem conhecido é o gráfico de número equivalente de resistência a corrosão alveolar (PREN), conforme mostrado abaixo.
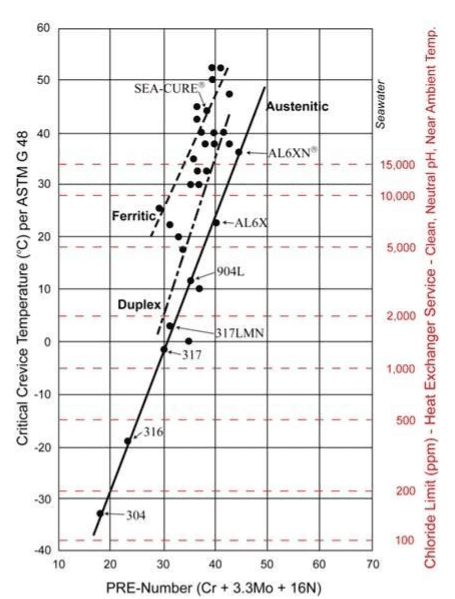
Materiais de liga mais alta além da série inoxidável austenítica 300 são recomendados para resfriamento de águas com cloretos apreciáveis. Para águas altamente salobras e água do mar, as ligas ferríticas e superferríticas, por exemplo, SEA-CURE®, são frequentemente necessárias.
Corrosão craniana
Corrosão de fenda é um mecanismo que se desenvolve nas fendas das juntas mecânicas, por exemplo, gaxetas de flange, extremidades enroladas de tubos, conexões de parafusos ou em outros locais, incluindo os limites dos depósitos. A Figura 7.13 mostra um exemplo de corrosão da fenda.

A água estagna nesses locais e pode se esgotar com oxigênio, o que torna as fendas anódicas ao outro metal. Como a corrosão alveolar, a corrosão é localizada.
Muitas vezes, a corrosão da fenda não é descoberta até uma interrupção programada ou se a corrosão causar uma falha do equipamento. A melhor abordagem para evitar a corrosão da fenda é eliminar a fenda. O tratamento químico adequado minimizará o depósito e a formação de fendas a partir dessa fonte, mas para equipamentos mecanicamente acoplados, é necessário cuidado na fase de projeto para eliminar fendas quando possível. Por exemplo, instalar gaxetas impermeáveis à água em conexões de flange pode ser uma solução em algumas aplicações.
Torta influenciada por manganês
Um fenômeno que atormentou vários trocadores de calor resfriados a água é a corrosão por manganês, com muitos problemas relatados ao longo do rio Ohio. Mesmo em concentrações tão baixas quanto 0,02 ppm, o manganês dissolvido em água de resfriamento pode ser oxidado em dióxido de manganês (MnO2) por cloração. Um revestimento fino semelhante a verniz aparecerá nas superfícies do trocador de calor.

Os depósitos de manganês são fortemente catódicos ao metal subjacente e podem causar corrosão localizada grave.

304 e 316 SS são muito suscetíveis à corrosão por depósito de manganês, mas também podem afetar latão admirável, latão de alumínio e cupro-níquel. O ataque é provável se o teor de manganês do depósito exceder cinco por cento. Uma concentração superior a 20% resultará em corrosão alveolar grave.
Outros fatores que induzem a formação de MnO2 incluem pH elevado, aeração e, às vezes, influências catalíticas pela própria superfície metálica. Além disso, a camada de MnO2 pode ser oxidada em permanganato (MnO4) por cloro. O permanganato dissolve o metal de base e, no processo, é reduzido de volta para MnO2. O ciclo se repete durante cada cloração. A corrosão de manganês aparentemente não é um grande problema com o aço macio, possivelmente porque outros produtos de corrosão impedem que o manganês forme um depósito uniforme e denso.
Os métodos de controle de deposição e corrosão de manganês incluem limitar ou eliminar a alimentação de biocidas oxidantes (potencialmente mudando para biocidas não oxidantes) e a aplicação de um programa eficaz de estabilização de manganês. A seleção de materiais resistentes à corrosão na fase de projeto é outra abordagem.
Corrosão por erosão
Se a água de resfriamento contiver sólidos suspensos significativos, bolhas de gás ou se a velocidade for simplesmente muito alta, o fluido que flui pode remover a camada de óxido protetor dos metais e permitir a corrosão contínua.

Por exemplo, em um estudo de fluxo de água do mar em aço macio, as seguintes taxas de corrosão foram medidas:
Tabela 7-A: Velocidade linear e taxas de corrosão da água do mar em aço leve
| Velocidade linear (pés/s) | Taxa de corrosão (mpy) |
| 1 | 7 |
| 4 | 15 |
| 17 | 35 |
Metais macios, como o latão Admiralty, são os mais suscetíveis à erosão, especialmente em distúrbios de fluxo, como a extremidade de entrada das chapas dos tubos do trocador de calor. Esses problemas devem ser levados em conta durante o projeto do projeto.
Cavitação
A cavitação é um tipo específico de corrosão por erosão que afeta mais comumente os impulsores da bomba centrífuga.

Se houver pressão insuficiente disponível na sucção da bomba (a pressão de entrada é chamada de “cabeça de sucção positiva líquida (NPSH)”), bolhas na água podem colapsar. As bolhas em colapso podem gerar forças localizadas muito grandes que removem o óxido protetor e danificam o metal. Outros locais potenciais para cavitação incluem descarga da válvula, reguladores, orifícios ou outros locais de queda de pressão. Possíveis problemas de cavitação devem ser abordados na fase de projeto do projeto para garantir que as bombas e outros equipamentos tenham pressão de cabeça suficiente.
Fadiga, fadiga por corrosão e rachadura por corrosão sob estresse
Praticamente todos os metais utilizados em aplicações convencionais, como tubulações, trocadores de calor e outros equipamentos, não são um único cristal, mas, de acordo com a referência 1, “são compostos por uma coleção de muitos cristais ou grãos pequenos”. A estrutura de grãos tem um enorme impacto na metalurgia e em vários mecanismos de corrosão.

Um exemplo direto de fadiga é facilmente demonstrado dobrando um clipe de papel ou um pedaço de fio repetidamente para frente e para trás até que ele se frature. As fraturas geralmente se alinham ao longo dos limites dos grãos. Os equipamentos da fábrica que realizam ciclos repetidos de carga podem sofrer de fadiga. A corrosão normalmente começa como microfissuras que crescem com o tempo. Pesquisas sugerem que a fadiga também pode ocorrer frequentemente em grãos, ou seja, transgranular.
A fadiga pode ser acelerada se o metal estiver imerso em um ambiente corrosivo, até mesmo em águas de processo básicas. À medida que as fissuras se desenvolvem, os produtos de corrosão (frequentemente apenas óxidos do metal de base) podem se acumular dentro das rachaduras e exacerbar o crescimento das rachaduras. Isso é fadiga por corrosão.
Outros mecanismos de corrosão intergranular além da fadiga podem ser bastante problemáticos, pois uma perda de metal relativamente pequena pode causar uma redução desproporcional na resistência do metal.

A corrosão intergranular é um ataque localizado que ocorre nos limites dos grãos, onde relativamente pouca perda de metal pode causar uma redução desproporcional na resistência do metal. O mecanismo mais conhecido é a rachadura por corrosão sob tensão (SCC) e pode ser particularmente problemático em aplicações de alta temperatura. (Consulte o Capítulo 4).
O CCS requer algum tipo de estresse metálico, mas onde o estresse pode ser interno ou aplicado.
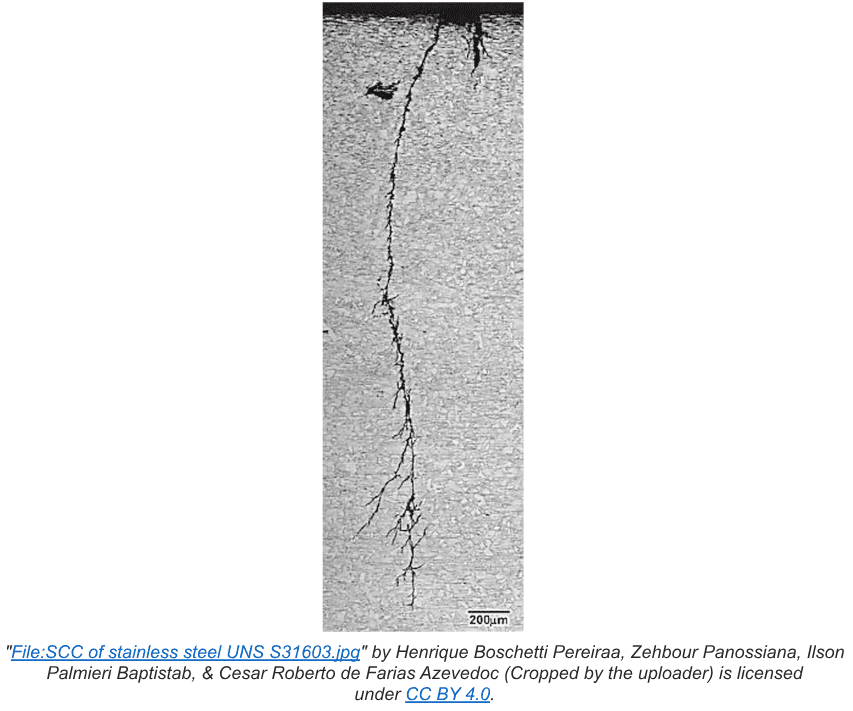
O estresse interno geralmente aparece durante o processo de fabricação. Um exemplo comum de estresse interno aplicado é trabalho a frio ou laminação a frio de aço para moldá-lo para uma especificação específica. O tubo selado é um exemplo bem conhecido. O tratamento com calor/recozimento é frequentemente utilizado para aliviar o estresse induzido pelo trabalho a frio.
Pontos fracos gerados pelo estresse podem se desenvolver em microfissuras que se tornam suscetíveis a agentes corrosivos na água. Talvez o exemplo mais conhecido seja o CCE induzido por cloreto de aço inoxidável. Em pontos de estresse, os ânodos se desenvolvem, que são cercados por metal não estressado que serve como o cátodo.
Os locais comuns para CCS em sistemas de água de resfriamento incluem roscas cortadas em porcas e parafusos, tubos enrolados em chapas de tubos, orifícios perfurados ou perfurados na tubulação do distribuidor e cotovelos de tubos onde o metal foi mecanicamente trabalhado.
O SCC pode ser mitigado pelo alívio do estresse do tratamento térmico. No entanto, nem sempre é prático aliviar o calor em todos os locais potenciais. Durante as inspeções do equipamento, o material estressado identificado ou suspeito deve receber atenção especial para determinar a eficácia dos programas de tratamento químico na minimização da corrosão.
A suscetibilidade à corrosão intergranular e por estresse é frequentemente maior nas soldas. Para aço de liga de cromo, o processo de soldagem pode causar a precipitação de carbonetos de cromo que geram pontos de esgotamento de cromo dentro do metal. Eles se tornam anódicos ao metal de base e se tornam suscetíveis à corrosão localizada. Muitas falhas ocorreram nas costuras de solda nos sistemas de água da fábrica. A seleção do material de enchimento de solda correto também é importante. Um problema sub-reconhecido é o uso de um material de enchimento que tem propriedades de expansão térmica diferentes do metal de base. Pode ocorrer fratura mecânica.
Corrosão galvânica
A corrosão galvânica ocorre quando dois metais diferentes estão em contato físico dentro do ambiente de água de resfriamento. Ouvido na Tabela 7-1, que descreveu os potenciais eletroquímicos para vários dos metais mais comuns para infraestrutura de água de resfriamento. Se dois metais forem acoplados, o mais reativo dos dois se tornará anódico ao menos reativo. Quanto maior a separação no potencial eletroquímico, maior a taxa de corrosão potencial. Um exemplo clássico é mostrado na figura abaixo.

Às vezes, as células galvânicas podem se desenvolver por reações químicas que ocorrem dentro do líquido. O mecanismo de corrosão por corrosão alveolar de manganês descrito anteriormente foi um exemplo. Outro mecanismo comum ocorre em sistemas que têm ligas de aço e cobre, mesmo que não estejam fisicamente conectados. Se as condições permitirem alguma corrosão de cobre, o cobre pode ser plaqueado no aço e produzir uma célula de corrosão galvânica.
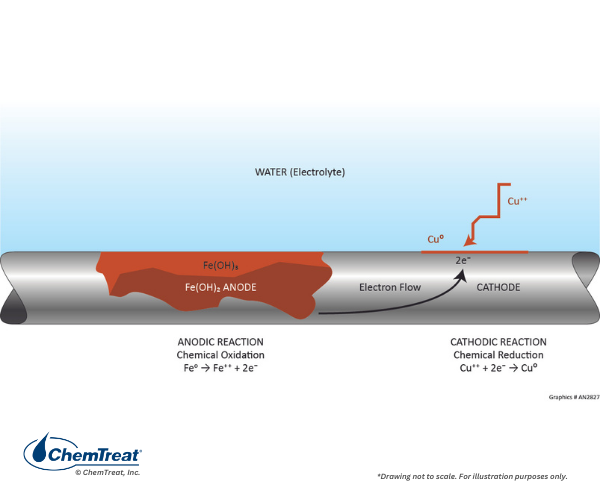
Este exemplo fornece uma excelente aplicação de dados da Tabela 7.1 examinando a reação através dos potenciais de meia célula.
Fe → Fe2+ + 2e–
Cu2+ + 2e– → Cu
V0 = 0,440 V
V0 = 0,340 V
E0 = 0,780 V
Existe um forte potencial de condução para esta reação.
A solução ideal para a corrosão galvânica é não ter metalurgias mistas em sistemas de resfriamento, mas esse arranjo geralmente é impraticável. Uma chave é ter uma pequena razão do material mais eletronegativo, por exemplo, cobre, em um sistema com uma quantidade muito maior do material eletropositivo, por exemplo, aço. Embora a corrosão galvânica ainda possa ocorrer, a grande relação ânodo/cátodo garante que o ataque seja espalhado por uma grande área e não cause danos graves.
Em outros casos, conexões ou encaixes especiais podem ser empregados para separar fisicamente metais diferentes.

Desligamento
Uma forma única de corrosão que às vezes ocorre nos tubos do trocador de calor é a desligação. O exemplo mais comum é a dezincificação de metais admirados. O latão Admiralty contém 70% de cobre, 29% de zinco e uma pequena quantidade de estanho, o último para ajudar a minimizar a dezincificação. Mesmo assim, a dezincificação ainda pode ocorrer. A Figura 7.24 mostra um tubo admirável que sofreu perda de zinco.

Foram postulados dois tipos de dezincificação: plugue e camada. Em ambos os casos, o zinco sai do substrato metálico, resultando em cobre poroso e quebradiço que não é estruturalmente sólido. Visualmente, o ataque aparece como uma mancha vermelha cega no metal de cobre amarelado.
O mecanismo de dezincificação real ainda é altamente debatido. Uma teoria é que ambos os metais corroem, com redepósito de cobre. O outro é que o zinco lixivia seletivamente da liga. As seguintes condições podem melhorar a dezincificação:
- Cloretos >350 ppm
- Resíduos de halogênio >1 ppm
- TDS >3.500 ppm
- pH >8,3
- Temperatura >120o F
Outro mecanismo de desligamento que foi relatado em raras ocasiões é a desnickelificação de ligas de cobre-níquel. Esse fenômeno parece ser bastante pouco frequente e não será discutido mais adiante neste livro.
Corrosão induzida microbiologicamente (influenciada)
A corrosão induzida microbiologicamente (MIC) é um processo no qual os micro-organismos iniciam, facilitam e/ou aceleram as reações à corrosão. Os sistemas de resfriamento proporcionam um ambiente ideal para micro-organismos estabelecerem colônias e formarem depósitos finos, parecidos com lama. (Detalhes adicionais são fornecidos na seção de controle microbiológico mais adiante neste capítulo.) Em primeiro lugar, os depósitos podem causar corrosão diferencial de oxigênio, conforme descrito anteriormente. Além dessa questão, no entanto, é que os processos metabólicos de alguns micróbios geram compostos que atacam diretamente os metais. Por exemplo, bactérias oxidantes de ferro, como a gallionella, produzem cloreto férrico, que é conhecido por acelerar a corrosão alveolar. Bactérias redutoras de sulfato (SRB), como desulfovibrio dessulfuricans, extraem oxigênio do sulfato (SO4) para produzir sulfeto de hidrogênio (H2S). Sulfetos de praticamente qualquer forma são bastante corrosivos para muitos metais.
O MIC pode deixar goivas lisas na superfície do metal, como mostrado na Figura 7.25 abaixo, e também pode causar corrosão rápida de alguns materiais, incluindo aços inoxidáveis.

Corrosão de metais não ferrosos e não metais
Até agora, grande parte da discussão tem sido sobre corrosão do aço, já que os aços compõem a maior parte do metal nos sistemas de resfriamento. No entanto, outros materiais metálicos e não metálicos estão frequentemente presentes, e eles também podem sofrer corrosão. As próximas seções examinam os problemas de corrosão para os materiais mais comuns.
Ligas de cobre
Ligas de cobre são frequentemente o segundo material mais comum em sistemas de água de resfriamento, normalmente para tubos de trocadores de calor. As ligas de cobre têm uma condutividade térmica mais alta do que o aço, são naturalmente tóxicas para muitas espécies aquáticas e são mais resistentes do que o aço a alguns mecanismos de corrosão.
Conforme indicado na Tabela 7.2, o cobre é nobre em relação ao íon hidrogênio e, portanto, não tende a corroer em ácidos. No entanto, o oxigênio é mais reativo do que o H+ e, em sistemas de água de resfriamento, ligas de cobre desenvolverão inicialmente uma multicamada de óxido cuproso (Cu2O) de porosidade variável, onde o cobre existe no estado de valência +1.
- 2Cu + O2 → Cu2O | Eq. 7-9
Ao longo do tempo, e na presença contínua de oxigênio ou outros agentes oxidantes, pode ocorrer oxidação adicional da camada externa de óxido cuproso para produzir uma camada acinzentada-preta de óxido cúprico (CuO).
- Cu2O + ½O2 → 2CuO | Eq. 7-10
Em alguns casos, a camada de óxido cúprico pode permanecer protetora, mas certos compostos, e mais notavelmente a amônia, podem ser muito corrosivos. Dissolve o íon cúprico através de um mecanismo conhecido como ligação d-orbital.
- Cu2+ + 4NH 3 → Cu(NH3)42+ (aq) | Eq. 7-11
Para águas de reposição contendo uma concentração significativa de amônia, por exemplo, efluentes de estações de tratamento de águas residuais, a corrosão do condensador de liga de cobre ou outros tubos de trocadores de calor pode ser uma preocupação significativa. A corrosão por liga de cobre às vezes tem sido problemática em sistemas de vapor onde a amônia é utilizada para controle de pH de condensado e água de alimentação.
Outra impureza que pode causar danos enormes a ligas de cobre (e outros metais) é o sulfeto, que, como foi observado, pode vir de colônias microbiológicas que contêm bactérias redutoras de sulfato.
- Cu2+ + H2S → CuS↓ + H2↑ | Eq. 7-12
Outras fontes potenciais de sulfeto incluem água que foi permitida a ficar séptica e de vazamentos de processo em refinarias e plantas semelhantes. Um exemplo surpreendente ocorreu há alguns anos, quando os tubos Cu-Ni antigos 90-10 em um condensador de superfície de vapor foram substituídos, apenas para que os novos tubos falhassem no ataque de corrosão alveolar dentro de 18 meses do comissionamento. A investigação revelou que o fabricante do tubo utilizou um lubrificante contendo sulfeto, mas não removeu o composto antes do envio para a planta. Os depósitos de sulfeto não foram eliminados, mas sim enterrados no metal em milhares de pontos.
Um produto de corrosão de cobre diferente, mas muito reconhecível, é o carbonato de cobre (CuCO3). Esse verdigris azulado/verde (também chamado de pátina) é frequentemente visto em estruturas de liga de cobre desgastadas, como telhados, placas e estátuas, e normalmente faz parte do design arquitetônico das estruturas.

A química básica é:
- 2Cu + H2O + CO2 + O2 → Cu(OH)2 + CuCO3↓ | Eq. 7-13
A cor pode ser um pouco variável, dependendo do grau de hidratação da película.
Zinco
Referindo-se novamente à Tabela 7.2, o zinco é anódico a quase todos os metais, exceto magnésio e alumínio. Ao contrário desses dois metais, no entanto, ele não forma uma camada de óxido superforte. Em vez disso, através do processo de galvanização onde um revestimento de zinco é aplicado às superfícies de aço, o zinco serve como um ânodo sacrificial para o ferro.
A galvanização está em uso desde 1742. A galvanização muito moderna é feita por imersão a quente, embora processos contínuos, como a galvanização de usinas pesadas, sejam comuns para chapas de aço. A imersão a quente é um processo em lote no qual componentes de aço recém-fabricados são imersos em uma solução de zinco fundido por um tempo prescrito. O zinco se funde à superfície de aço. A espessura do revestimento é diretamente proporcional à duração da imersão, que pode ser ajustada por tamanho do componente e aplicação.
Os materiais recém-galvanizados são frequentemente brilhantes e muito reflexivos, conforme mostrado na Figura 7.27.

No entanto, nem todos os revestimentos galvanizados são brilhantes. Alguns elementos no aço, por exemplo, silício e fósforo, podem acelerar o crescimento de camadas de liga de zinco-ferro. Isso pode produzir um revestimento galvanizado acabado que consiste inteiramente em liga de zinco-ferro.

A formação da pátina protetora cinza escuro (acabamento superficial) começa com o desenvolvimento de uma fina camada de óxido de zinco na superfície. Sob condições adequadas, esses óxidos incorporarão uma camada de carbonato de zinco básico quando em contato com a água. Após a exposição inicial à água e ao dióxido de carbono (que pode ser obtida permitindo que novos componentes do sistema de resfriamento galvanizado experimentem condições externas ao longo de um período de vários meses), os componentes industriais galvanizados podem então ser expostos à água do sistema. A etapa de condicionamento requer controle cuidadoso para produzir um composto de carbonato de zinco hidratado que se acredita ter a seguinte fórmula:
- 3Zn (OH)2∙ZnCO3∙H2O
Essa camada cresce e se torna mais protetora ao longo do tempo, mas se a química adequada da água não for estabelecida durante o processo de condicionamento, um material não protetor conhecido como “ferrugem branca” pode se formar. Mais detalhes sobre a química de passivação de zinco são examinados em uma seção posterior sobre a inicialização pré-operacional de sistemas de resfriamento.
Componentes galvanizados são comuns em muitos locais de torres de resfriamento, mesmo que a estrutura de suporte principal seja madeira ou plástico.
Muitas torres de resfriamento comerciais de tamanho modesto podem ser completamente fabricadas a partir de aço galvanizado.

Alumínio
Ao pensar na Tabela 7.1 no início deste capítulo, é difícil imaginar que o alumínio e, em alguns casos, o magnésio, são adequados para fins de construção, pois são tão reativos. O segredo é que a alta reatividade induz a formação de uma camada de óxido apertada que protege o metal por baixo. Os produtos típicos de alumínio incluem moldes de injeção, blocos de motor, radiadores, escadas e passarelas de torres de resfriamento, corrimãos, lâminas de ventiladores e outros componentes semelhantes. O alumínio é resistente à corrosão atmosférica e esse aspecto, juntamente com seu peso leve, o torna um excelente material para componentes de aviões.
O alumínio é um material anfotérico, o que significa que ele corroerá em pH baixo e alto.
O alumínio pode corroer em águas alcalinas com fosfato. Além disso, como o alumínio é o mais ativo eletroquimicamente do que o aço, ele corroerá quando acoplado ao aço em ambientes de água de resfriamento.
Problemas de corrosão não metálica
Esta seção examina brevemente dois problemas de corrosão não metálica relacionados principalmente a grandes torres de resfriamento. Estes são a degradação da madeira (que pode servir como estrutura de suporte da torre) e do concreto, que é um material comum para as bacias da torre de resfriamento.
Degradação de madeira
Para as muitas torres de resfriamento grandes que ainda têm componentes de madeira, esta seção fornece uma visão geral das influências de degradação. A deterioração da madeira pode geralmente ser classificada em três categorias: física, química e microbiológica.
- Físico
- Temperaturas da água de resfriamento excessivamente elevadas superiores a 140o F
- Dano por gelo
- Erosão
- “Ferro apodrecido” de fixadores de metal enferrujados adjacentes (Figura 7.30)
- Dano cíclico úmido/seco
- Estresse mecânico (Figura 7.31)


- Químico
- Concentrações elevadas de cloro excedendo 1,0 ppm, o que pode deslignificar a madeira. A lignina é o aglutinante para fibras de celulose em madeira, mas pode ser destruída por um alto teor de halogênio.
- Linhas de injeção de produtos químicos colocadas perto de estruturas de madeira. Se essas linhas desenvolverem vazamentos, os produtos químicos concentrados podem atacar a madeira.
- Altos valores de pH acima de 9,0. O pH elevado pode ser especialmente destrutivo quando combinado com altas concentrações de cloro. Os programas de tratamento de água de resfriamento são normalmente projetados para operar abaixo desse pH.
- Biológico (principalmente relacionado a fungos)
- Os fungos são responsáveis pela decomposição e destruição da madeira
- Os fungos existem como leveduras (unicelulares) e bolores (filamentos multicelulares)
- Os fungos prosperam em uma faixa de pH levemente ácida de 5,5–6,5.
- Os fungos exigem altos níveis de carbono orgânico, em comparação com as bactérias. Segue-se que a proliferação de fungos em água a granel é relativamente rara, a menos que haja contaminação orgânica, talvez por vazamentos de processo de hidrocarbonetos ou se o suprimento de diluente for efluente municipal da estação de tratamento de águas residuais.
A discussão a seguir descreve os três tipos principais de podridão da madeira fúngica.
Roteiro marrom: A podridão marrom, também conhecida como podridão seca, é mais comum em madeiras macias e ataques sob a camada conservante aplicada durante a fabricação. Os fungos vão atrás da celulose, deixando ligninas de cor escura para trás. Ela pode penetrar profundamente na madeira.

Roteiro branco: A podridão branca é mais comum em madeiras duras e ataca as ligninas. Ela progride mais lentamente do que a podridão marrom. A superfície da madeira torna-se macia e áspera e parece branqueada. A podridão branca pode ser controlada por tratamentos de fungicidas de superfície em estágios iniciais de crescimento. O fungicida penetra lentamente na madeira.

Roteiro macio: A podridão suave ocorre apenas em áreas lavadas com água e é confinada à superfície nos estágios iniciais. O ataque é mais lento do que a podridão branca ou marrom. A superfície parece rachada e de cor clara quando seca. A podridão suave pode ser controlada por tratamento microbiológico diligente da água de resfriamento.

Corrosão de concreto
O concreto foi o material de construção para as grandes torres de resfriamento hiperbólico em usinas nucleares e algumas usinas de carvão no século passado. Praticamente nenhuma torre hiperbólica foi construída nas últimas décadas e não será considerada mais aqui. No entanto, muitas das grandes torres mecânicas de tiragem na indústria pesada e de energia têm reforçado bacias de concreto.

O concreto é forte, despejado no local e pode ter uma vida longa. Um problema comum ao longo dos anos veio em plantas onde o ácido sulfúrico é utilizado para controle do pH da água de resfriamento e onde o ácido não é diluído antes da injeção na bacia. O ácido sulfúrico resistente a commodities (concentração de 93 a 98%) tem uma densidade quase o dobro da água e afundará rapidamente no chão da bacia se não for diluído, onde pode atacar o concreto e as barras de reforço de concreto.
O método primário para minimizar tais danos é um sistema de diluição de ácido, que mistura externamente ácido e água, com distribuição da mistura através de uma calha acima da bacia.

O cimento padrão de Portland pode ser atacado por águas com alta concentração de sulfato (>1.500 ppm), o que é possível em alguns sistemas de resfriamento de acordo com o efeito de concentração da torre. Esse problema pode ser abordado na fase de projeto com um cálculo cuidadoso da qualidade da água de reposição e até que ponto o sulfato se concentrará quando a torre for ciclada até os níveis normais. As condições podem exigir o uso do cimento Portland Tipo V, que tem uma quantidade reduzida de aluminato tricálcico, normalmente um dos componentes primários do cimento padrão.
Antes de examinar os métodos de controle de corrosão, analisaremos as principais causas de deposição e incrustação em sistemas de refrigeração. Programas de tratamento de água passados e presentes são geralmente misturas de inibidores de corrosão e depósito e, portanto, a discussão de um frequentemente inclui o outro.
Mecanismos de Deposição
Além da formação de incrustação, a deposição de sólidos em sistemas de resfriamento pode ocorrer por vários mecanismos adicionais, incluindo:
- Assentamento em áreas de fluxo restrito
- Contaminação por partículas transportadas pelo ar que entram na torre de resfriamento
- Incrustações microbiológicas
- Incrustação macrobiológica
- Incrustação de graxa e óleo ou outros contaminantes orgânicos do processo
- Produtos de corrosão de outras áreas do sistema
Problemas de fluxo restrito
Um local de fluxo restrito comum, descrito no Capítulo 6, é o enchimento da torre de resfriamento.
O enchimento de película de alta eficiência fornece excelente transferência de calor, mas pelo preço de uma trajetória de fluxo torturante que reduz a velocidade da água. O fluxo acelerado para trocadores de calor também pode estabelecer zonas de baixo fluxo que coletam sólidos. Um item frequentemente negligenciado com grandes sistemas de resfriamento são pernas mortas que podem acumular materiais, incluindo micróbios.
Particulados transportados pelo ar
As torres de resfriamento são excelentes purificadores de ar, e muitos sólidos podem ser introduzidos através desse caminho de fluxo. A entrada de poeira durante períodos secos é um problema comum. Outro exemplo clássico com o qual muitos operadores estão familiarizados é a intrusão de sementes de lenha de algodão e vegetação folhosa adicional que entupe filtros e outros equipamentos.
Incrustação microbiológica
Água e ar são preenchidos com micróbios que podem potencialmente formar colônias problemáticas em todos os sistemas de resfriamento. A incrustação pode ocorrer muito rapidamente e, potencialmente, forçar a redução da capacidade da unidade ou até mesmo o desligamento do equipamento dentro de dias do início microbiano. O lodo protetor secretado por alguns micróbios aprisiona facilmente sólidos suspensos que convertem o material em um produto semelhante à lama.

Incrustação macrobiológica
Várias criaturas aquáticas que escapam das telas de entrada de água de resfriamento podem bloquear as extremidades de entrada dos tubos do trocador de calor. Essas dificuldades têm sido particularmente problemáticas em condensadores de superfície de vapor de usina de energia de passagem única. Algumas das criaturas mais comuns incluem mariscos asiáticos, mexilhões de zebra e até mesmo peixes pequenos, como sombra.
Incrustação de contaminantes do processo
Muitas grandes indústrias têm numerosos trocadores de calor. Vazamentos no trocador de calor podem introduzir contaminantes no retorno da água de resfriamento para a torre. São particularmente problemáticos os óleos e hidrocarbonetos pesados que podem revestir os equipamentos do sistema de resfriamento.
Deposição do produto de corrosão
A corrosão é problemática por si só, mas a corrosão libera produtos que se alojam em outros locais.
Formação de escala
O Capítulo 1 incluiu uma discussão sobre produtos de solubilidade e como, quando vários íons dissolvidos atingem um limite de solubilidade, ocorre a precipitação de sólidos. Este é o mecanismo por trás da formação de incrustação em sistemas de água.

No Capítulo 2, aprendemos que o precipitado mais comum em águas naturais é o carbonato de cálcio (CaCO3) e como a química de precipitação de CaCO3 pode ser usada vantajosamente em reações de amaciamento de cal para o tratamento de água de reposição. Por outro lado, a formação indesejada de incrustação de carbonato de cálcio em sistemas de água, incluindo o encanamento doméstico, atormenta a humanidade há anos e cujo tratamento lançou a química moderna de controle de incrustação que conhecemos hoje. Para analisar brevemente, quase todas as águas naturais contêm íons de cálcio dissolvidos (Ca2+) e alcalinidade de bicarbonato (HCO3–). De acordo com várias influências, incluindo temperatura, os íons precipitarão da solução. A reação a seguir é representativa desse processo.
- Ca2+ + 2HCO 3– + calor → CaCO3↓ + CO2↑ + H2O | Eq. 7-14
O carbonato de cálcio tem três polimorfos. Calcite é a forma termodinamicamente mais estável e compreende a maioria dos depósitos naturais.

Uma forma menos estável é a aragonita, que é encontrada principalmente no CaCO3 biossintético, como conchas e corais. A estrutura final é a vaterita, que raramente ocorre na natureza, mas desempenha um importante papel de transição na formação de carbonato de cálcio a partir da solução.
A deposição de carbonato de cálcio foi o impulsionador para o desenvolvimento dos primeiros programas para prever tendências de formação de incrustação (e corrosão) de impurezas da água. Esses desenvolvimentos estão destacados abaixo.
Índices de saturação
Índice de saturação de Langelier (Langelier Saturation Index, LSI)
Em 1936, o Dr. Wilfred F. Langelier (1886–1981) estava pesquisando um problema de corrosão na tubulação de abastecimento de água para Cleveland, Ohio. Ele aprendeu que a corrosão poderia ser reduzida aumentando o pH da água tratada, mas com a compensação do aumento do potencial de incrustação do carbonato de cálcio.
Ele desenvolveu o LSI; um modelo de equilíbrio derivado da avaliação teórica da saturação de carbonato de cálcio. Diz-se que uma água está em saturação com carbonato de cálcio quando não dissolve nem precipita o mineral. Seus cálculos poderiam prever quando a incrustação de carbonato de cálcio ocorreria medindo as concentrações de cálcio, alcalinidade de bicarbonato, pH e sólidos dissolvidos totais, em toda a faixa de temperatura comum da água.
A equação fundamental é:
- LSI = pH – pHs | Eq 7-15
Onde;
- pH = O pH real medido
- pHs = O pH da saturação de carbonato de cálcio. É um valor calculado onde o carbonato de cálcio em solução está em equilíbrio com o carbonato de cálcio precipitado.
- pHs = (pK2 ‒ pKs ) + pCa + pAlk Eq 7-16
- pK2 = log10 negativo da segunda constante de dissociação para ácido carbônico; pKs = log10 negativo do produto de solubilidade (Ksp ) para calcita (CaCO3); pCa = log10 negativo da concentração de cálcio; e pAlk = log10 negativo da concentração de alcalinidade total.
- pHs = (pK2 ‒ pKs ) + pCa + pAlk Eq 7-16
Os valores para pK2 e pKs são uma função da temperatura. À medida que a técnica LSI ganhava favor, os pesquisadores desenvolveram nomógrafos que permitiam o cálculo rápido de (pK2 ‒ pKs) dentro das faixas de temperatura de recirculação típicas de uma vez ou abertas.
A correlação empírica dos cálculos é resumida da seguinte forma:
- LSI <0, a incrustação de carbonato de cálcio se dissolverá e existe potencial para corrosão leve do aço.
- LSI = 0, a água é estável em relação à formação e dissolução de carbonato de cálcio.
- LSI >0, o potencial para formação de incrustação de carbonato de cálcio aumenta com o aumento do LSI.
Langelier conseguiu controlar a corrosão evitando a formação de incrustações ajustando a alimentação de cal para manter uma faixa de +0,5 a +1,0 LSI na água da cidade.
Para sistemas de água de passagem única e fechada, a adição de álcali para aumentar o LSI para 0,5 ou aproximadamente pode minimizar a corrosividade, mas não alcançar condições de formação de incrustações graves. Em um sistema de resfriamento de recirculação, pode ser possível elevar o LSI ou os outros índices descritos abaixo aumentando os ciclos de concentração, o que aumenta a dureza do cálcio e a alcalinidade do carbonato.
Índice de estabilidade de Ryznar (RSI)
Em 1944, John W. Ryznar (1912–1996) propôs uma modificação substancial ao LSI. Ele descobriu que era possível que águas de baixa dureza e alta dureza tivessem o mesmo LSI, dependendo da alcalinidade e pH relacionado. Ryznar nomeou sua relação como Índice de estabilidade e substanciou suas RSI com dados experimentais. A equação de Ryznar emprega os mesmos dados que o LSI, mas o cálculo final é:
- RSI = 2pH s – pH | Eq 7-17
A correlação empírica das RSI está resumida da seguinte forma:
- RSI < 6, a tendência à escala de carbonato de cálcio aumenta à medida que o índice diminui.
- RSI = 6, a água é estável em relação à formação e dissolução de carbonato de cálcio.
- RSI > 6, a incrustação de carbonato de cálcio se dissolverá e a corrosão leve do aço se torna uma probabilidade crescente com valores crescentes.
Índice de escala prática (PSI)
O Índice de Escala Prática (PSI) foi desenvolvido por Paul Puckorius (1930 – 2019), que, quando jovem, era assistente de Ryznar. Ele incorpora um pH calculado da água com base na capacidade de tamponamento, em vez de simplesmente medir o pH. A equação do índice de escala prática (PSI) é:
- (PSI) = 2(pHs) ‒ pHeq | Eq. 7-18
- pHeq = 1,465 x log10 (alcalinidade total) + 4,54 | Eq. 7-19
A correlação empírica da PSI é a mesma que a RSI. Pelo menos um dos principais fabricantes de turbinas de combustão utiliza o PSI para o cálculo de tendências de incrustação para resfriadores de ar de entrada. Colocar os cálculos em um programa de planilhas é simples.
Outros índices preditivos estão disponíveis, incluindo o Índice de Oddo-Tomson, o Índice de Stiff-Davis, os Níveis de saturação, o Excesso momentâneo e outros. Neste ponto, é útil introduzir um outro cálculo, o índice de Larson-Skold para o potencial de corrosão. Os ânions agressivos, como cloreto e sulfato, são mais eletricamente condutores do que os ânions tamponantes, bicarbonato e carbonato. Na década de 1950, o Dr. T. E. Larson e o Dr. R. V. Skold estudaram a corrosividade das águas dos Grandes Lagos e desenvolveram a seguinte fórmula.
- Índice de Larson-Skold = (epm Cl– + epm SO42-)/(epm HCO3– + epm CO32-) | Eq. 7-20
(epm = equivalentes por milhão)
Eles descobriram que, quando a razão entre ânions fortes e ânions fracos era inferior a 0,2, os ânions tamponantes têm uma influência maior do que os ânions corrosivos e podem formar uma película inibidora natural. No entanto, quando o índice sobe acima de 0,6, a situação é revertida e o potencial de corrosão é maior. A relação empírica de Larson-Skold foi baseada especificamente nas águas dos Grandes Lagos. Embora relações semelhantes possam ser calculadas para outras águas, as previsões podem ser diferentes.
Embora algumas empresas de tratamento de água ainda usem esses cálculos para uma avaliação rápida das tendências de incrustação de água, os métodos não têm os recursos dos programas de computador modernos, que são responsáveis por fatores adicionais, incluindo o efeito iônico comum. Programas bastante sofisticados estão disponíveis que permitem que o usuário insira não apenas as condições do sistema e a química da água bruta, mas também os tipos e concentrações reais de inibidores de incrustação. Os programas calcularão a faixa normal e as condições de limite para qualquer programa de tratamento desejado. As próximas seções examinam mecanismos adicionais de incrustação.
Outras escalas
Dependendo da química da água de reposição, ou de como ela muda quando ligada a uma torre de resfriamento, outros depósitos minerais são possíveis em sistemas de resfriamento. A Tabela 7-2 descreve os mais comuns.
Tabela 7-2. Outros depósitos comuns de incrustação de água de resfriamento
| Composto | Fórmula |
| Gesso | CaSO4∙2H2O |
| Sílica | SiO2 |
| Silicato de magnésio | MgSiO3 |
| Fosfato de cálcio | Ca3(PO4)2 |
| Fluorito | CaF2 |
Como será mostrado, alguns problemas de descamação e, mais notavelmente, aqueles relacionados à deposição de sulfato e fosfato, em grande parte surgiram de avanços ou mudanças nos programas de tratamento químico.
Antes de prosseguir, um ponto importante deve ser destacado em relação aos compostos minerais na Tabela 7-2 em comparação com CaCO3. O ânion no carbonato de cálcio é CO3. Em termos químicos alternativos, CO3 é a “base conjugada” do ácido fraco H2CO3. Uma discussão sobre ácidos e bases conjugadas está além do escopo deste livro, mas a ideia principal é que depósitos de carbonato geralmente podem ser removidos por aplicação de ácido, mesmo em forma diluída.
- CaCO3 + H2SO4 → Ca2+(aq) + SO42-(aq) + H2CO3 | Eq. 7-21
- H2CO3 - CO2↑ + H2O | Eq. 7-22
Assim, se o ácido for fornecido em quantidades suficientes com contato uniforme, os depósitos de CaCO3 se dissolverão totalmente à medida que o carbonato se converte em dióxido de carbono. A alimentação de ácido sulfúrico para a composição da torre de resfriamento foi, e em alguns casos ainda é, um método comum para reduzir a alcalinidade e reduzir o potencial de formação de incrustação de CaCO3. Os requisitos de alimentação ácida muitas vezes não são grandes o suficiente para causar precipitação de sulfato de cálcio, mas o problema não pode ser ignorado.
Sulfato de cálcio
Um problema às vezes problemático é a incrustação de gesso (CaSO4∙2H2O), influenciada por concentrações elevadas de sulfato na composição ou do tratamento com ácido para remover o carbonato.
O sulfato de cálcio tem maior solubilidade do que o CaCO3, conforme mostrado abaixo.
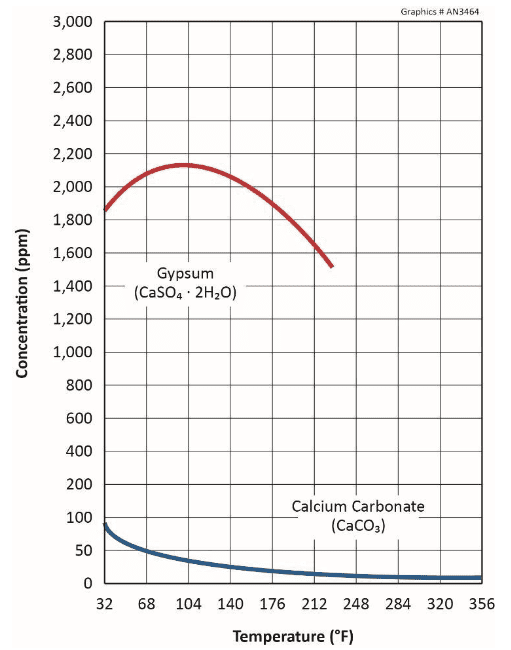
A figura revela que o gesso também exibe solubilidade reversa, mas não até que as temperaturas atinjam aproximadamente 105o F.
Uma diretriz geral comum sugere limites de 1.200 ppm de cálcio (mg/L como CaCO3) e 1.200 ppm de sulfato (mg/L como SO4), ou alguns múltiplos dos mesmos, para evitar a formação de incrustações em temperaturas normais do sistema de resfriamento em água não tratada. Limites mais altos podem ser possíveis com o tratamento químico, mas esses casos devem ser avaliados individualmente.
Fosfato de cálcio
Como será descrito em mais detalhes na próxima seção, na década de 1980, ocorreu uma grande mudança no tratamento químico de sistemas de recirculação aberta com a adoção de produtos químicos de fosfato inorgânicos e orgânicos para controle de incrustação e corrosão. De repente, a deposição de fosfato tricálcico (Ca3(PO4)2) tornou-se um grande problema em muitas instalações.
Além do fosfato tricálcico (Ca3(PO4)2), outras fases do fosfato de cálcio podem se formar na água de resfriamento. Muitas vezes, presume-se que a hidroxiapatita termodinamicamente estável (Ca5(PO4)3(OH)) é um protótipo adequado para previsão de escala. Parece que durante a precipitação do fosfato de cálcio, o fosfato de cálcio amorfo (ACP) se forma primeiro, seguido pela nucleação e transformação de fase de outros compostos.
ACP → Precursor → Fase estável
A solubilidade do fosfato(s) de cálcio depende fortemente do pH e da temperatura da solução. Todas as espécies mostram solubilidade inversa em relação a esses dois parâmetros. A tendência de incrustação do fosfato de cálcio também depende de outras influências, incluindo aquelas de outros íons metálicos. Todos os fatores devem ser considerados ao calcular o potencial de escala.
Sílica/Silicatos
A química aquosa da sílica é complexa e qualquer número de precipitados pode se formar dependendo da temperatura, pH e outros fatores. Depósitos potenciais incluem:
- Sílica amorfa em seções mais frias do sistema de água
- Silicatos metálicos em locais quentes/quentes ou em pH elevado
- Minerais de silicato, como argila, suspensos na água
A sílica amorfa é simplesmente SiO2. Muitas águas de superfície contêm baixos níveis (<15 ppm) de sílica, no entanto, algumas águas subterrâneas podem ter concentrações de até 75 a 80 ppm. Em temperatura ambiente, o nível de saturação de sílica é de cerca de 150 ppm, de modo que à medida que a concentração de sílica aumenta para saturação e acima, um processo de polimerização induz a formação de sílica coloidal que pode se fixar às superfícies do sistema. Esse depósito ocorre principalmente nos locais mais frios, como o enchimento da torre.
Na faixa de pH de aproximadamente 2,0–8,3, a solubilidade da sílica é independente do pH, no entanto, a sílica dissolvida se converte em silicato (SiO3–) à medida que o pH sobe acima de 8,3. Os silicatos precipitarão com cátions, mais notavelmente magnésio e cálcio. Esses compostos exibem solubilidade inversa em relação ao pH e temperatura e, portanto, se acumularão primeiro em locais quentes, isto é, trocadores de calor. As incrustações de sílica e silicato são muito tenazes e difíceis de remover. Eles também são isolantes fortes que reduzem significativamente a transferência de calor.
Alguns programas de tratamento químico podem permitir a operação com concentrações de sílica dissolvida em ou talvez até mesmo um pouco acima de 200 ppm. No entanto, o conhecimento completo da química da água é necessário para empurrar o envelope do programa. Por exemplo, íons polivalentes, como Zn2+ e Al3+, são cercados por grupos hidroxila que podem catalisar a polimerização de sílica. Entre todos os cátions, o magnésio tem o maior potencial de induzir a deposição de silicato.
A sílica dissolvida pode ser analisada por espectrofotometria ultravioleta/visível (UV/VIS) através do método de molibdato. A medição total de sílica, incluindo a forma coloidal onde a sílica existe como partículas sólidas, requer técnicas mais avançadas, tais como plasma acoplado indutivamente (ICP) ou espectroscopia de absorção atômica (AA).
Controle de Deposição e Corrosão
Métodos de tratamento químico para controle de corrosão e incrustação têm sido interligados há anos, e esta seção fornece uma revisão dos programas mais comuns ao longo da última metade do século ou mais, e como métodos passados e presentes foram projetados para abordar ambos os problemas.
Ouça a Equação 7-14. Em meados do século passado, um programa de tratamento extremamente popular para sistemas de recirculação aberta foi a alimentação de ácido sulfúrico para controle de incrustação (para estabelecer uma faixa de pH comum de 6,5-7,0), com alimentação de cromato dissódico (Na2Cr2O7) para controle de corrosão. Este último composto fornece íons de cromato (CrO42-) que reagem com o aço carbono para formar uma camada de aço pseudo-inoxidável que pode ser bastante protetora.
No entanto, nas décadas de 1970 e 1980, o reconhecimento precoce da toxicidade por cromo hexavalente (Cr6+) levou a uma proibição da descarga de cromo no meio ambiente, que essencialmente eliminou o tratamento com cromato para sistemas de água de resfriamento abertos. O programa de substituição foi bem diferente, com um conceito-chave sendo a operação em um pH levemente básico (normalmente cerca de 8,0 ou talvez um pouco mais alto) para auxiliar no controle de corrosão. Os principais produtos químicos de tratamento tornaram-se fosfatos inorgânicos e orgânicos. Mas, como veremos, essa química mais complicada (em comparação com o ácido-cromato) aumentou o potencial de incrustação. A Figura 7.41 ilustra sucintamente a relação geral entre corrosão e incrustação.
A capacidade do fosfato de influenciar o pH é demonstrada pela reação do fosfato trissódico (Na3PO4, TSP) em água.
- Na3PO4 + H2O - NaH2PO4 + NaOH | Eq. 7-23
A química do TSP tem sido utilizada há décadas para ajustar o pH em geradores de vapor de alta pressão (consulte o Capítulo 4). Mas os fosfatos inorgânicos, quando aplicados isoladamente à água de resfriamento, podem induzir a formação pesada de Ca3(PO4)2 e, de fato, quando a química do fosfato surgiu como substituição do cromato ácido, a deposição de fosfato de cálcio tornou-se muito problemática. Assim, surgiram formulações que incluíam polifosfatos, fosfatos orgânicos (também conhecidos como fosfonatos), polímeros e, muitas vezes, uma pequena concentração de zinco, todos projetados para controle integrado de incrustação e corrosão.
A concentração de fosfato residual ideal depende de fatores como o índice LSI/RSI/PSI da água, pH, temperatura e o tipo de outros inibidores no programa de tratamento. Excesso de fosfato pode resultar em incrustação de fosfato tricálcico em superfícies quentes. O fosfato também pode precipitar com ferro e alumínio.
Uma faixa típica de controle de ortofosfato é de 6 a 18 ppm.
Polifosfatos
Os polifosfatos contêm vários átomos de fósforo conectados entre si através de pontes de oxigênio, conforme mostrado na Figura 7.42. Os polifosfatos geralmente contêm de 3 a 5 unidades e têm átomos de oxigênio carregados negativamente que atraem cátions, incluindo cálcio e ferro. Essa atração sequestra efetivamente os cátions, impedindo que eles formem depósitos.
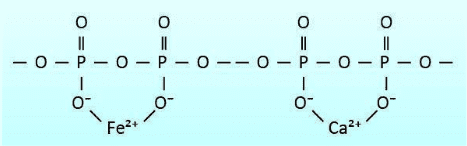
Uma “concentração limite” é necessária para inibir a incrustação de carbonato de cálcio quando as concentrações estão em níveis de saturação. O polifosfato também se combina com manganês. Tripolifosfato de sódio ((Na5P3O10), pirofosfato tetrassódico (Na4P2O7) e hexametafosfato de sódio ((NaPO3)6) são apenas alguns dos polifosfatos. Normalmente, 2 a 5 ppm de polifosfato são necessários em um programa de tratamento. Os polifosfatos hidrolisarão e reverterão para ortofosfato, onde vários fatores, como tempo de residência e temperatura, influenciam a taxa de reversão.
Organofosfatos
Os fosfonatos inibem a formação de incrustações por adsorção em cristais ativos para retardar a nucleação e a taxa de crescimento de cristais. Os fosfonatos também atuam como sequestrantes que formam complexos com vários cátions. Alguns fosfonatos fornecem proteção contra corrosão, como é brevemente descrito aqui e na seção a seguir. Quatro fosfonatos comuns são mostrados abaixo.
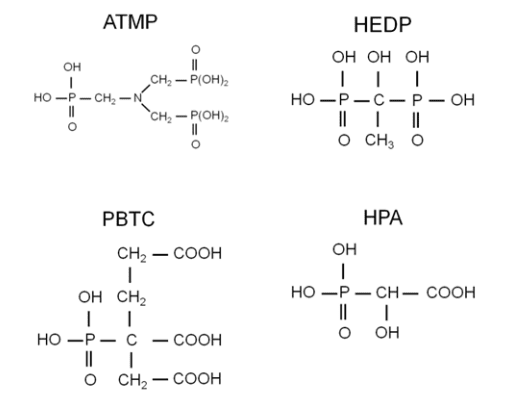
ATMP foi o primeiro fosfonato e foi introduzido no início da década de 1970 para controle de incrustação de carbonato de cálcio. Ele serviu como um substituto para polifosfatos e poderia estender os índices de saturação descritos anteriormente para:
- LSI em +1,5
- RSI/PSI em ‒1,5
ATMP exibiu propriedades inibidoras de corrosão justas a boas nas faixas de pH alcalino dos (então novos) programas de fosfato-fosfonato. No entanto, a ATMP tem baixa tolerância à oxidação de biocidas como o cloro e também pode formar precipitados de cálcio-fosfonato.
Uma melhoria veio com o HEDP, que tem desempenho semelhante ao ATMP, mas tem uma tolerância maior aos oxidantes. O HEDP substituiu o ATMP na maioria das aplicações. Pesquisas adicionais levaram ao desenvolvimento de CTSP, que tem tolerância ainda maior para cloro e bromo do que HEDP. Observe os grupos de ácido carboxílico (COOH) nesta molécula, que revertem para carboxilato (COO–) em soluções alcalinas. O carboxilato é um grupo funcional fundamental para muitos dispersantes de controle de depósito. O PBTC oferece boa proteção contra corrosão, no entanto, é mais caro do que outros produtos.
A HPA é uma adição mais recente à família de inibidores de incrustação/corrosão de organofosfato e é particularmente eficaz porque forma uma camada monomolecular com cálcio em superfícies metálicas.
Os fosfonatos são quase sempre misturados com outros agentes de controle de depósito e inibidores de corrosão (principalmente anódicos). A faixa normal de controle de fosfonato é de 2 a 10 ppm (como PO4).
Desenvolvimentos de polímeros
O desenvolvimento de polímeros para modificação e sequestro de cristais melhorou a química de controle de depósito. A Figura 7.44 ilustra vários grupos funcionais para polímeros de tratamento de água importantes.
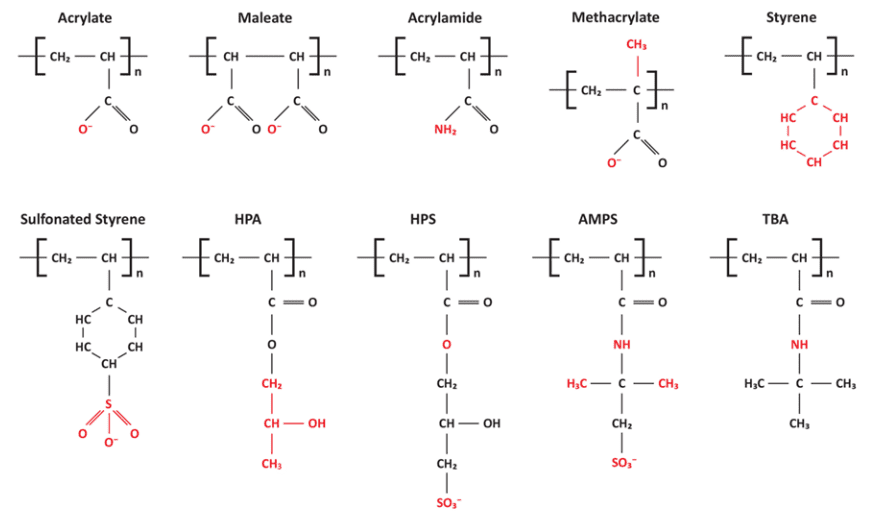
Figura 7.44. Grupos funcionais em polímeros de controle de depósito. HPA, acrilato de hidroxipropila; HPS, 2-hidroxipropilsulfonato; AMPS: Ácido 2-acrilamido-2-metilpropano sulfônico; TBA, acrilato de terc-butila.
Juntamente com os grupos funcionais, a estrutura e o tamanho do polímero têm influência na inibição da incrustação. São comuns moléculas de 500–15.000 daltons de tamanho, mas em alguns casos polímeros muito maiores podem funcionar bem. Alguns polímeros foram projetados para controlar o carbonato de cálcio, sulfato de cálcio e depósitos relacionados ao ferro, e outros para controlar os fosfatos de cálcio que podem surgir dos programas de tratamento com fosfato/fosfonato.
Formulações avançadas podem incluir copolímeros, ter e quad-polímeros que têm vários grupos funcionais diferentes para tratar águas complexas. Os compostos inibem a formação de incrustações através de vários mecanismos, incluindo sequestro, modificação de cristais e dispersão de cristais.
Sequestro
Como pode ser observado na Figura 7.44, alguns dos compostos têm os mesmos grupos funcionais, isto é, sulfonato e carboxilato, que aqueles em resinas de troca iônica para tratamento de água de reposição (ver Capítulo 3). Para ambas as aplicações, os sítios ativos carregados negativamente se ligam a cátions, incluindo cálcio e magnésio. A principal diferença é que as resinas sólidas de troca iônica estão contidas dentro de um recipiente, enquanto os polímeros solúveis e móveis de controle de depósito se movem por todo o sistema de água de resfriamento. Nomes genéricos ou comerciais comuns para esses polímeros incluem:
- Poliacrilato (PAA)
- Polimetacrilato (PMAA)
- Polimaleato (PMA)
- Copolímero AA/amps
Modificação de cristal
Alguns polímeros modificam ou distorcem cristais incipientes.

Cristais distorcidos não exibem nenhum dos cristais de face plana ou tipo agulha mostrados na Figura 7.45a, em vez disso, a estrutura é muito mais frágil, friável e não forma grãos de cristal grandes. PA, PMA e compostos similares são eficazes para controlar o carbonato de cálcio.
O controle da incrustação de fosfato de cálcio é mais difícil, especialmente em superfícies de transferência de calor. A prevenção de incrustações pode exigir copolímeros ou terpolímeros que incluam grupos sulfonados.
O ferro apresenta um desafio para a química do polímero, pois o ferro se liga fortemente a sítios carboxílicos e sulfonados, reduzindo sua eficácia para o sequestro de cálcio. Em muitas águas, no entanto, a concentração de ferro é baixa e não apresenta problemas significativos.
Dispersão de cristais
Os dispersantes poliméricos são carregados principalmente negativamente. Partículas suspensas geralmente também têm uma carga negativa geral. Os polímeros aumentam a carga negativa, causando maior repulsão que mantém as partículas em suspensão. A dispersão pode ser eficaz em sólidos suspensos de tamanho fino, como lodo, argila e produtos de corrosão, e possivelmente alguns detritos microbiológicos. PAA e PMA são bons produtos para dispersão.
Um fator frequentemente importante para o controle de depósitos é aumentar a capacidade dos polímeros de penetrar depósitos. Isso é especialmente verdadeiro para orgânicos, incluindo óleos e graxas, pois esses compostos ligam os depósitos. O biofilme também é um agente de ligação especialmente forte. Os surfactantes podem ajudar a decompor esses materiais. Compostos catiônicos, aniônicos e não iônicos estão todos disponíveis.
Surfactantes não iônicos são semelhantes aos detergentes por terem um grupo funcional hidrofílico (amante da água) e uma cadeia lipofílica (amante do óleo). À medida que a extremidade lipofílica se liga aos óleos, a extremidade hidrofílica se liga às moléculas de água para remover o óleo. Modificações estruturais nos locais ativos lipofílicos e hidrofóbicos permitem química de solvato especializada.
Surfactantes aniônicos servem para dispersão de lodo e sólidos suspensos. Surfactantes aniônicos às vezes produzem espuma, que geralmente não é um problema com compostos não iônicos.
Os dispersantes catiônicos são principalmente biodispersantes ou biocidas. Mais detalhes sobre esses produtos químicos são fornecidos na seção de controle microbiológico deste capítulo.
Métodos de projeto para ajudar a controlar a deposição
Quando o lodo ou a macroincrustação afetar o desempenho do trocador de calor, a instalação do equipamento de retrolavagem pode ser benéfica se a unidade puder ficar off-line periodicamente para limpeza.
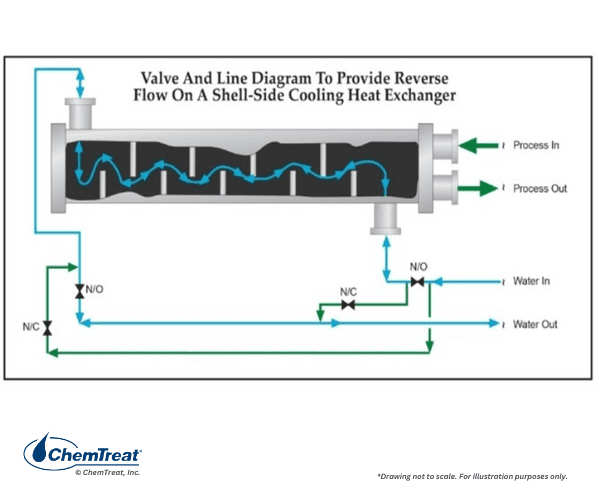
Outra modificação é instalar um coletor abaixo do trocador de calor para bater no ar na água do lado da carcaça. Isso é ilustrado no desenho abaixo.

Controle de corrosão
As seções de abertura deste capítulo descreveram muitos dos problemas mais importantes de corrosão do sistema de refrigeração. Agora vamos examinar as técnicas modernas de controle de corrosão.
Quando os programas de água de resfriamento de recirculação aberta foram trocados de tratamento ácido-cromato para fosfato-fosfonato-polímero-zinco, grande parte da química dos últimos programas também serviu para o controle de corrosão.
Considere novamente o diagrama básico do mecanismo de corrosão mais comum em sistemas de água de resfriamento, ataque de aço carbono por oxigênio dissolvido. Como lembrete, a oxidação e a perda de metal ocorrem em ânodos, com transferência de elétrons e redução de espécies dissolvidas em cátodos.
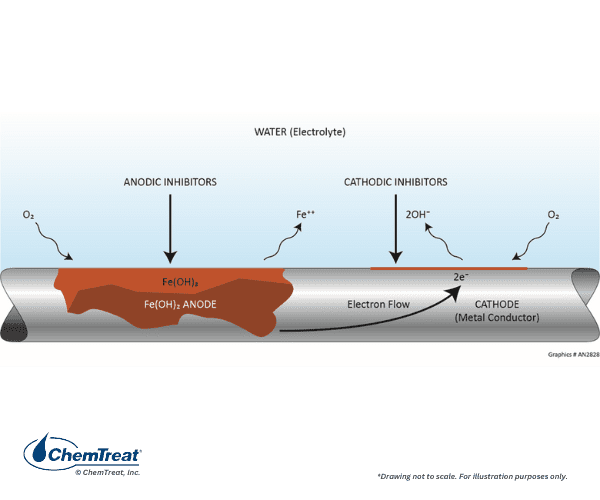
Inibidores de corrosão despolarizam efetivamente (reduzem ou interrompem o fluxo elétrico) a reação de corrosão no ânodo ou cátodo, ou ambos, com programas de inibidores combinados. Em geral, os inibidores catódicos precipitam no local catódico de pH localmente alto para formar uma barreira que limita a taxa de redução de oxigênio. Inibidores anódicos tipicamente promovem a formação de um óxido metálico estável na superfície do ânodo. Isso limita a dissolução do metal. Um avanço considerável veio com o desenvolvimento de produtos formadores de película que protegem toda a superfície metálica. A revisão dessa tecnologia de filmagem segue a discussão abaixo sobre a inibição anódica e catódica tradicional.
Tabela 7-3. Inibidores comuns de corrosão
| Anódico | Catódico | Filmagem |
| Molibdato | Fosfatos orgânicos | Azóis (para ligas de cobre) |
| Nitrito | Ortofosfato | Filmagem de aminas |
| Ortofosfato | Polifosfatos | Polissilicatos |
| Zinco | RPSI* |
Carbonato de cálcio – O inibidor natural da corrosão
A seção anterior sobre a formação de incrustações sugeriu que o carbonato de cálcio é o depósito mais natural e frequentemente mais problemático. No entanto, quando as concentrações de alcalinidade de cálcio e bicarbonato existem em moderação, a presença de ambos pode ser benéfica. Se a água tiver pelo menos 50 ppm de dureza de cálcio e 50 ppm de alcalinidade (ambos como CaCO3), os constituintes potencialmente oferecem alguma proteção contra corrosão como um inibidor catódico. A chave é que, nos cátodos mostrados na Figura 7.47, a produção de íons hidroxila gera uma região localizada de pH elevado. Isso pode induzir a formação de uma camada leve de carbonato de cálcio que inibe a transferência de elétrons nos cátodos.
Ortofosfato
Como foi descrito, o ortofosfato é um ingrediente primário em programas de fosfato-fosfonato para elevar o pH para uma faixa levemente alcalina e minimizar a corrosão geral. Além disso, o ortofosfato reage com o ferro (Fe2+) gerado nos ânodos para formar um precipitado de fosfato de ferro que se deposita nos ânodos e ajuda a inibir as reações eletroquímicas. Análises de espectroscopia eletrônica mostraram que a camada inibidora real é um complexo gama-ferro com uma fórmula de FeOOH•FePO4. O composto passiva ânodos e reprime reações de corrosão. Esse filme monomolecular se decompõe ao longo do tempo e, portanto, requer uma concentração contínua de fosfato.
O ortofosfato também atua como um inibidor catódico sob certas condições. Assim como o pH mais alto localizado no cátodo precipita o carbonato de cálcio e, como veremos, o hidróxido de zinco, ele também pode precipitar o fosfato de cálcio.
Polifosfato
Conforme observado, o polifosfato sequestra cátions multivalentes, como cálcio e ferro, para inibir a incrustação. Esses complexos desenvolvem uma carga líquida positiva e migram para os cátodos para formar um depósito de barreira. O depósito bloqueia o oxigênio da superfície, reduzindo a corrente de corrosão.
Zinco
O zinco tem sido um aditivo padrão para programas de fosfato-fosfonato, com uma concentração comum recomendada de 0,5-1,0 ppm. O zinco reage com os íons hidroxila produzidos nos cátodos para formar um precipitado de hidróxido de zinco (Zn(OH)2) que despolariza as reações catódicas. O zinco pode ser eficaz contra corrosão por corrosão alveolar. Tem sido uma prática comum combinar zinco com um inibidor de corrosão anódico, como ortofosfato, para proteção completa contra corrosão.
Muitos compostos de zinco são altamente insolúveis, incluindo fosfato de zinco e, se houver contaminantes de sulfeto, sulfeto de zinco.
Preocupações ambientais com a química do fosfato-fosfato-Zinco
De preocupação considerável e crescente é a descarga de fósforo em corpos naturais de água, e os efeitos que tal descarga tem na proliferação de flores de algas tóxicas.

Em muitos locais agora, a descarga de fósforo é limitada se não for totalmente proibida. Também está sendo restrita a descarga de metais, incluindo zinco e cobre. Essas restrições são um fator importante na movimentação de programas à base de fósforo para programas alternativos de formação de filmes.

REDUZIR O USO DE FOSFATO EM UMA FÁBRICA DE AMÔNIA COM A TECNOLOGIA DE RESFRIAMENTO FLEXPRO®
Química de filmagem
Como as seções anteriores sugeriram, a principal função dos inibidores de corrosão é proteger as superfícies metálicas. Os programas de ácido-cromato anteriores foram excelentes nesse sentido, pois ao longo do tempo o cromato reagiria com toda a superfície metálica e estabeleceria continuidade, desde que a concentração residual suficiente fosse mantida na água de resfriamento. Mas a mudança nos programas de fosfato-fosfonato alterou essa metodologia. A inibição da corrosão é, em grande medida, realizada pela precipitação de produtos sólidos em cátodos e ânodos. Esses depósitos podem ser lavados, permitindo corrosão localizada. Por outro lado, a sobrealimentação pode induzir precipitação intensa de fosfato de cálcio e, às vezes, fosfonatos de cálcio.
Consequentemente, de acordo com um esforço de pesquisa de vários anos discutido na referência 3, a ChemTreat desenvolveu um conjunto de programas de controle de corrosão sem fosfato/sem zinco e sem incrustação, que “interagem diretamente com superfícies metálicas para formar um complexo inibidor de polihidroxiamido reativo (RPSI) que é independente de cálcio, pH ou outros constituintes químicos da água”. A química estabelece uma camada protetora direta em superfícies metálicas, ao contrário dos programas de fosfato/fosfonato que dependem da deposição de produtos de reação para formar barreiras protetoras que, como foi observado, podem ser difíceis de controlar.
Um exemplo clássico da necessidade de métodos aprimorados de proteção contra corrosão é mostrado na ilustração a seguir de um trocador de calor de tubo e invólucro de duas passagens, cuja água de resfriamento na época foi tratada com um programa tradicional de fosfato-fosfonato.

Na extremidade de entrada do trocador de calor (os tubos inferiores desta unidade), a corrosão foi problemática. No lado da saída mais quente (a metade superior), a deposição e a formação de incrustações foram problemáticas. Assim, o programa original não foi eficaz na mitigação da corrosão ou deposição, dependendo da localização. Uma mudança para a química RPSI eliminou ambos os problemas.

Controle de corrosão da água de resfriamento fechada (CCW)
O resfriamento primário em muitos setores é um aspecto crítico da operação, e transtornos podem custar muito dinheiro em perda de eficiência e produção. Mas, muitas vezes, são negligenciados os sistemas de água de resfriamento fechados auxiliares, que também atendem a processos vitais. Falhas em sistemas fechados têm o potencial de paralisar uma parte ou toda a planta.
O controle químico rigoroso é um aspecto que torna o resfriamento fechado eficaz para muitas aplicações. Mas a negligência do tratamento e monitoramento da água pode levar à corrosão e incrustação.
O termo sistema de água de resfriamento “fechado” é um pouco de mau nome, pois praticamente todos os sistemas sofrem vazamentos ou pequenas perdas que exigem reposição. (Se ocorrer corrosão grave, essas perdas podem ser significativas.) Os sistemas são frequentemente projetados com um tanque principal para reposição e para lidar com mudanças na demanda. Alguns tanques principais estão abertos para a atmosfera, permitindo que o oxigênio entre na água de resfriamento e influencie o potencial de corrosão.
Embora possa ser possível utilizar água com qualidades variadas em sistemas CCW, uma escolha comum e o foco principal desta discussão é a água condensada ou desmineralizada que é especialmente tratada. A seleção de condensado em vez de água menos pura minimiza a possibilidade de dificuldades de compostos de dureza formadores de incrustação ou agentes corrosivos, como cloreto e sulfato. Para sistemas que podem congelar potencialmente durante o tempo frio, pode ser necessária uma solução de glicol. Essa química pode obviamente influenciar os requisitos de monitoramento e dosagem.
O material típico da tubulação para sistemas CCW é aço carbono, com aço inoxidável ou talvez ligas de cobre sendo uma escolha comum para tubos de trocadores de calor ou placas em um permutador de placa e estrutura. Outros metais podem incluir alumínio ou aqueles metais contidos em conexões soldadas dentro de bobinas de resfriamento de trocador de calor. Ao planejar um programa de tratamento, é importante conhecer a metalurgia completa do sistema.
Dois inibidores comuns de corrosão da água de resfriamento são nitrito e molibdato, conforme descrito abaixo.
Nitrito
Nitrito (NO2‒), geralmente alimentado como nitrito de sódio (NaNO2), é um inibidor anódico em virtude da reação química com hidróxido de ferro nos ânodos. O nitrito de sódio é um produto químico barato e seguro de manusear. Conforme mostrado nas reações a seguir, o nitrito promove a formação de uma camada passiva de óxido de ferro na superfície metálica.
- 9Fe (OH)2 + NO2 → 3Fe3O4 + NH4 + 2OH + 6H2O | Eq. 7-24
- 9Fe (OH)2 + NO2 → 3(Fe2O3) + NH4 + 2OH + 3H2O | Eq. 7-25
Comum é a adição de um construtor de alcalinidade/agente tampão para manter o pH dentro de uma faixa levemente alcalina.
Inibidores anódicos, como o nitrito, também são conhecidos como inibidores “perigosos”, pois se os resíduos caírem abaixo dos limites, um pequeno número de ânodos se desenvolverá em um grande ambiente catódico. Pode ocorrer corrosão rápida. Consequentemente, uma faixa de resíduos de nitrito comum recomendada é de 500 a 1.000 ppm para inibir a corrosão geral e a corrosão alveolar. No entanto, quando usado com outros inibidores, como o molibdato, os resíduos de nitrito mais baixos podem ser satisfatórios. Uma preocupação com o nitrito é que ele é um excelente nutriente para bactérias. Nitrobactera agilis pode crescer rapidamente convertendo nitrito em nitrato. Um exemplo clássico vem de uma fábrica de montagem de automóveis, onde bactérias nitrificantes obstruíram os tubos de água de resfriamento pequenos e serpentinos em soldadores automáticos. Biocidas oxidantes não são adequados para controle microbiológico, pois os oxidantes convertem nitrito em nitrato. Um biocida não oxidante (consulte a discussão mais adiante neste capítulo) pode fornecer controle eficaz.
Molibdato
Molibdato de sódio (Na2MoO4) foi usado pela primeira vez como inibidor de corrosão em 1939 para sistemas de resfriamento automotivo. Parece que o molibdato age de forma semelhante ao cromato e adsorve na matriz de óxido de ferro nos ânodos.
- Fe2+ + MoO42- → FeMoO4↓ | Eq. 7-26
Essa camada pode então evoluir ainda mais para o que é conhecido como complexo de ferro gama. Pesquisas mostram que o molibdato age como um inibidor de corrosão alveolar de acordo com sua capacidade de se acumular dentro da parte ácida de um poço e bloquear o processo de corrosão. Uma faixa de controle comum para molibdato é de aproximadamente 1/3 de nitrito. Embora o molibdato seja um oxiânion, ele requer algum oxigênio residual para ser eficaz. Oxigênio dissolvido suficiente pode entrar através da composição da água de resfriamento ou do tanque principal para fornecer a quantidade necessária.
O molibdato é um produto químico caro e os custos podem ser proibitivos em algumas aplicações.
Inibição da corrosão de liga de cobre
O cobre é um metal excelente para transferência de calor e, portanto, ligas de cobre foram selecionadas para muitos tubos de trocadores de calor. Embora o cobre seja um metal mais nobre do que o ferro, corrosão significativa é possível em certos ambientes. Como observado anteriormente, a combinação de oxigênio dissolvido e amônia pode ser particularmente corrosiva. Os métodos de controle de corrosão mais populares há anos têm utilizado azóis, em outro exemplo de química formadora de película. A Figura 7.52 ilustra o efeito geral.
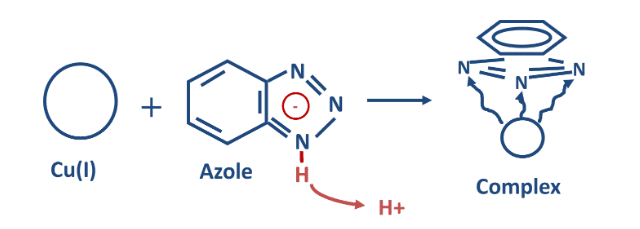
Os azóis se ligam a átomos de cobre na superfície metálica por meio de um grupo de nitrogênio ativo. O anel orgânico em forma de placa forma então uma barreira para proteger o metal do fluido a granel. Os azóis mais comuns estão listados abaixo.
Benzotriazol
1,2,3-Benzotriazol (BZT – C6H5N3) é o composto mostrado na Figura 7.52. É o azol mais fundamental, mas oferece boa inibição de corrosão em sistemas de água de resfriamento circulante.
Toliltriazol
O toltriazol (TTA – C7H7N3) é semelhante ao BZT, mas com um grupo metil adicionado ao anel orgânico.
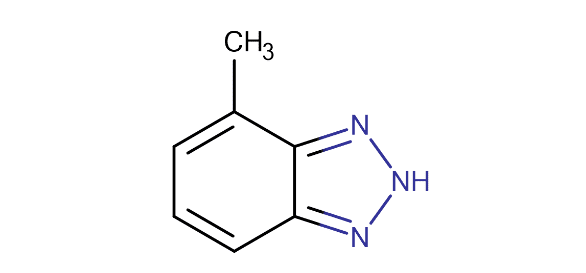
O grupo metil ajuda a orientar a molécula para estabelecer uma película de barreira mais uniforme.
Outro dos azóis iniciais é o 2-mercaptobenzotiazol (MBT), que tem dois grupos de enxofre no anel de nitrogênio. Um dos átomos de enxofre também se liga ao cobre para formar uma película passiva espessa.
Uma dificuldade com esses compostos originais é o ataque por biocidas oxidantes, que, é claro, são necessários para o controle microbiológico. As empresas de tratamento de água desenvolveram azóis resistentes a halogênio que contêm grupos laterais adicionais para resistir ao ataque de oxidantes.
As concentrações recomendadas de azol são geralmente mantidas dentro de uma faixa de 1 a 10 ppm e, muitas vezes, de 2 a 5 ppm.
Além da ligação com a superfície metálica, os azóis também formam complexos com íons de cobre livres em solução. Portanto, o cobre dissolvido contribui para a “demanda” do azol, que deve ser atendida antes que a filmagem de superfície possa ocorrer. No entanto, se o azol for aplicado adequadamente, qualquer cobre livre deve desaparecer rapidamente e normalmente não estar presente depois disso. Os azóis continuam sendo uma parte importante de muitos programas FlexPro.
Aminas
O agente redutor orgânico dietilhidroxilamina (DEHA, (C2H5)2NOH)) é um passivador de metal, bem como um absorvedor de oxigênio, e pode ser usado em sistemas fechados. A maioria dos outros agentes redutores, incluindo hidrazina, carboidrazida, eritorbato e metiletilcoetoxima, raramente são utilizados fora dos sistemas de caldeira.
A reação de passivação do ferro pela DEHA é a seguinte:
- 27Fe2O3 + (C2H5)2NOH → 18Fe3O4 + N2↑ + 4CH3COOH + 3H2O | Eq. 7-27
As vantagens dos passivadores orgânicos incluem que eles contribuem com muito pouca condutividade para a água, reduzem quimicamente o oxigênio, tamponam a água e passivam o metal. Isso pode ser muito importante para alguns processos de resfriamento que têm fluxo de calor e temperaturas da pele de metal extremamente altos. Na fabricação de aço, por exemplo; a fornalha, a lança e os eletrodos são expostos a temperaturas acima de 3.000 °F (1.650 °C). Outros processos industriais expõem equipamentos de resfriamento a correntes elétricas muito altas, como soldadores automatizados em fábricas de montagem automotiva. Água com TDS alto pode causar arco elétrico e curtos-circuitos que danificam o equipamento. Água de resfriamento com baixo TDS (≤500 μS/cm) é frequentemente necessária em tais aplicações, um requisito que pode ser possível com passivadores orgânicos.
Inibidores adicionais
Alguns compostos adicionais podem, em certas situações, servir como inibidores de corrosão. As próximas seções examinam duas delas.
Silicatos
Usado pela primeira vez em 1921, ortossilicato de sódio, ou como o ânion SiO32‒, é um inibidor de corrosão anódico do tipo precipitação semelhante ao ortofosfato. Os silicatos têm sido inibidores populares em sistemas de água potável, pois são atóxicos e ocasionalmente encontram uso para aplicações de água de resfriamento.
O ortossilicato é tecnicamente uma mistura de monômeros de sílica que coexistem com sílica polimerizada, também conhecida como polissilicato (Figura 7.54). A porcentagem de compostos poli vs. orto depende do produto original do silicato, da concentração do silicato em água, do pH e do tempo de retenção.
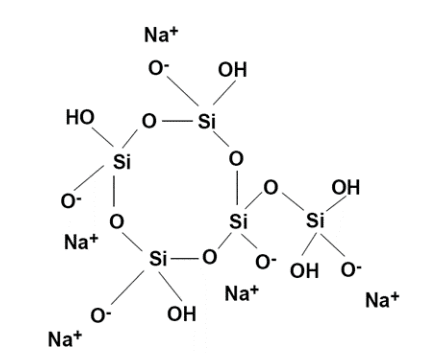
O ortossilicato é inicialmente adsorvido em ânodos na superfície metálica, onde reage com o ferro para formar uma fina camada monomolecular.
- Fe2+ + SiO32- + 2H2O → FeO∙Si(OH)3↓ + ½H2↑ | Eq 7-28
A camada bloqueia o contato oxigênio-metal e reduz a corrosão. Por fim, toda a superfície metálica fica coberta, isolando efetivamente o metal das reações eletroquímicas. O exame microscópico e de raios X da barreira de silicato indica a formação de duas camadas, com a maior parte da sílica em uma camada superficial adjacente à água.
Uma diretriz comum é uma dosagem inicial de silicato para estabelecer um residual de 25 ppm acima da concentração de fundo. 30 a 60 dias de operação neste nível é típico. A concentração pode então ser reduzida para 8–12 ppm acima do fundo para controle normal. O filme não se desenvolve sobre si mesmo e, portanto, não formará incrustação. No entanto, o tratamento pode ser muito problemático em sistemas de recirculação aberta ou trocadores de calor com alta transferência de calor devido ao potencial de formação de incrustação de magnésio ou silicato de cálcio. Outro possível agente poluente é o silicato de alumínio, que pode resultar se o alúmen for utilizado como coagulante para clarificação pré-tratamento da água de reposição.
Borato
O tetraborato de sódio penta-hidratado (Na2B4O7•5H2O) é um inibidor anódico que protege metais ferrosos contra a corrosão. Parece que o borato produz uma camada de borato férrico em superfícies metálicas, incentivando a formação de óxido férrico que atua como uma barreira ao transporte de íons de ferro, particularmente íons férricos, a partir da superfície metálica. Por ser um inibidor relativamente fraco, o borato suplementa outros inibidores, como nitrito ou silicato. Uma característica fundamental dos boratos é uma boa capacidade de tamponamento a um pH levemente básico de 8,3 ou ligeiramente acima.
Os boratos e o ácido bórico podem proteger contra várias formas de degradação da madeira por fungos, no entanto, as concentrações necessárias são muito maiores do que aquelas que podem ser razoavelmente mantidas em sistemas de refrigeração de recirculação.
Controle de corrosão por meio de seleção de materiais e eletroquímica
Em algumas aplicações, métodos estão disponíveis para proteger metais por métodos mecânicos ou elétricos. Esta seção analisa um de cada um, galvanizando do lado dos materiais e usando ânodos de sacrifício de um aspecto elétrico.
Galvanização
A galvanização de aço carbono é comum para muitas aplicações, incluindo componentes estruturais de torre de resfriamento. Pequenas torres de resfriamento galvanizadas (consulte a Figura 6.9 no capítulo anterior) muitas vezes podem ser ideais do ponto de vista de equilíbrio entre estabilidade estrutural e custo.
O condicionamento adequado do revestimento galvanizado para estabelecer uma pátina de zinco cinza escuro protetora é essencial para a longa vida útil do zinco. Isso pode ser obtido expondo componentes galvanizados à atmosfera por um período de vários meses. Como mostrado anteriormente na Figura 7.28, os trens de proteção ao longo de estradas e outras estruturas de zinco expostas à atmosfera desenvolvem esta pátina naturalmente.
Para componentes de torre de resfriamento que são instalados sem exposição atmosférica de longo prazo, o condicionamento do material por talvez dois meses antes da unidade ser colocada em serviço é necessário para evitar a formação de “ferrugem branca”. Os detalhes deste produto químico são descritos mais adiante na “Seção de limpeza pré-operacional e passivação” deste capítulo.
Proteção elétrica: Ânodos atuais sacrificiais ou impressos
A tecnologia de ânodo sacrificial está disponível há décadas para proteger tubos, tanques, reservatórios de água do condensador e outros equipamentos. Nessas aplicações, um metal mais reativo do que o aço, por exemplo, magnésio, alumínio, zinco, é acoplado à estrutura em locais estratégicos. Quando as células de corrosão se desenvolvem, os elétrons fluem do elemento mais reativo através dos fios de conexão para a estrutura e locais catódicos no aço. Isso deixa o aço intacto às custas de blocos de metal facilmente substituíveis.
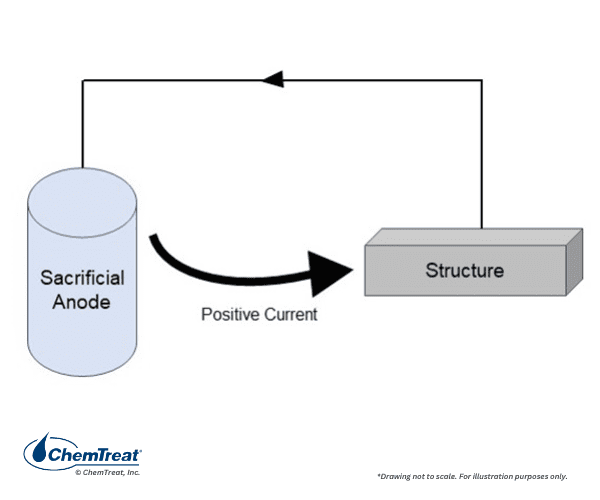
De acordo com a referência 4, uma versão mais avançada do processo é a proteção catódica de corrente impressionada, na qual “alguma fonte externa de energia de corrente contínua é conectada (ou impressionada) entre a estrutura e os ânodos do leito de aterramento”. Esses sistemas são comuns em tubulações. Como a corrente é gerada diretamente, ânodos menos reativos do que magnésio e alumínio são aceitáveis e podem incluir sucata de baixa liga.
Sistemas de ânodo atuais sacrificiais e impressionados devem ser cuidadosamente projetados, pois podem ser subespecificados ou superespecificados. Uma corrente muito baixa permitirá que o metal primário corroa em ânodos localizados, enquanto uma corrente demais pode gerar reações na superfície do metal que causam o ataque, por exemplo, fragilização do hidrogênio. Outras discussões estão além do escopo deste livro.
Preocupações microbiológicas
Os sistemas de água de resfriamento proporcionam um ambiente ideal, quente e úmido, para o crescimento microbiológico. As bactérias podem formar colônias em muitos locais, os fungos atacam a madeira da torre de resfriamento e as algas se proliferam em áreas ensolaradas, particularmente nos decks e outras áreas expostas. Micro-organismos mais avançados, como ameba e protozoários, muitas vezes se multiplicam em colônias microbianas estabelecidas. Esses organismos mais complexos podem aumentar o crescimento da bactéria Legionella.
Para controlar micro-organismos, biocidas registrados pela EPA, oxidantes e não oxidantes, são rotineiramente empregados, às vezes em conjunto com um biopenetrante/biodispersante. Esta seção discute os micróbios comuns que florescem em sistemas de água industriais e descreve estratégias de controle.
Bactérias
As bactérias consistem em procariontes unicelulares (micróbios que não têm um núcleo celular definido) e podem ser tão pequenos quanto 0,1 mícron. As bactérias podem ser classificadas em cinco grupos de acordo com suas formas básicas: esférico (cocos), haste (bacilos), espiral (espirila), vírgula (vibrios) ou saca-rolhas (espirquetes). Eles podem existir como células individuais, em pares, cadeias ou agrupamentos. A forma sozinha, no entanto, não é um bom indicador de um tipo de bactéria porque uma única cepa de bactérias pode assumir diferentes formas, dependendo das condições de crescimento. Diferentes espécies podem ter morfologias semelhantes.
As bactérias têm uma ampla variedade de necessidades de nutrientes, oxigênio e energia. Bactérias aeróbicas exigem oxigênio, enquanto bactérias anaeróbicas prosperam sem oxigênio. Anaeróbios facultativos são micróbios que produzem energia por respiração aeróbica se houver oxigênio, mas podem mudar para um processo de fermentação se houver ausência de oxigênio. As bactérias são categorizadas como planctônicas (flutuação livre) na água a granel ou sésseis nas colônias ligadas às superfícies. Os micróbios sésseis são responsáveis pelos biofilmes e geralmente são a principal preocupação quando se trata de impacto no desempenho do sistema de água.
As bactérias também são agrupadas por faixas de temperatura ideais para o crescimento; bactérias termofílicas, acima de 122o F (50°C), mesófilos dentro de uma faixa de 68-99° F (20-37°C) e psicofilos a 39-50°F (4-10°C). Os micróbios que podem crescer e prosperar em ambientes extremos são chamados de extremófilos e, embora cada espécie de bactéria cresça melhor dentro de uma faixa de temperatura ideal, a maioria também pode se adaptar e crescer em temperaturas fora da faixa ideal.
Na maioria dos sistemas de água de resfriamento industrial modernos, o pH é mantido em uma faixa alcalina para controle de corrosão, e isso é ideal para o crescimento bacteriano. As bactérias mais comuns são as do gênero Pseudomonas, mas outras espécies incluem:
- Bactéria redutora de sulfato (SRB)
- Bactérias relacionadas ao ferro (IRB)
- Bactérias formadoras de limo
- Bactérias nitrificantes
- Bactérias desnitrificantes
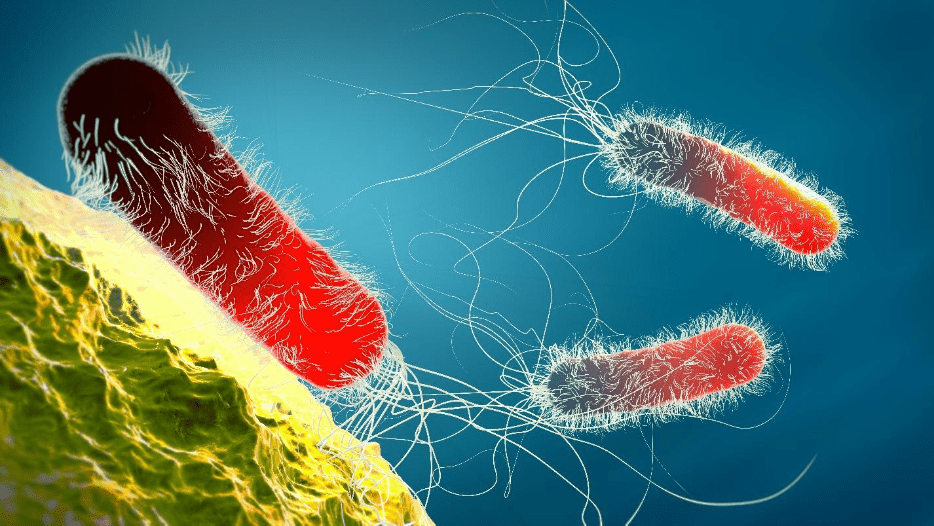
Quando as colônias se desenvolvem, aeróbios, anaeróbios e organismos facultativos geralmente se estabelecem dentro da biomassa.
Fungos, leveduras e bolores
O termo fungos inclui leveduras e bolor. Os fungos são um grupo de organismos eucarióticos não fotossintéticos que são maiores em tamanho do que as bactérias. A maioria dos fungos é aeróbica e requer oxigênio para sobreviver. Leveduras, como as de cervejas ou vinícolas, são anaeróbios facultativos. Os fungos são organismos importantes para muitos processos de tratamento de resíduos, pois eles decompõem o material orgânico. Em sistemas de água de resfriamento industrial, esses atributos podem ser prejudiciais. Os fungos Basidiomycetes e Ascomycetes podem atacar a madeira da torre de resfriamento.
Enquanto a levedura é um tipo de fungo que contém apenas células únicas, os fungos contêm múltiplos núcleos idênticos. As colônias são caracterizadas por filamentos pluricelulares (e, às vezes, coloridos) semelhantes a fios chamados hifas. Os bolores são importantes industrialmente para a produção de antibióticos e queijos.
Os fungos prosperam em ambientes ácidos e são menos ativos em sistemas modernos de água de resfriamento por operação típica dentro de uma faixa de pH levemente básica. No entanto, não é incomum encontrar fungos em depósitos de biofilme, o que sugere um ambiente ácido dentro do biofilme.

Algas
As algas são um grupo diversificado de organismos aquáticos fotossintéticos que requerem luz solar. As algas são fotoautótrofos, o que significa que podem produzir muitos nutrientes necessários a partir de dióxido de carbono, água e luz solar. O fosfato é um nutriente crítico adicional e é um fator limitante no crescimento.
Em sistemas de resfriamento de recirculação abertos, as algas crescem nas áreas expostas ao sol, mais notavelmente nos decks de torres de fluxo cruzado. Muitas dessas torres cobriram decks para bloquear a luz solar, limitando assim as oportunidades de crescimento de algas. Se não for verificada, a incrustação de algas pode levar a um fluxo desequilibrado de água na torre de resfriamento e à redução da eficiência operacional. No entanto, as algas podem aparecer em outras áreas ensolaradas.

Micróbios e biofilmes
Como observado anteriormente, os micróbios na água de resfriamento são de flutuação livre ou sésseis. As condições do sistema, em alguma medida, ditarão o desenvolvimento séssil. Por exemplo, altas velocidades podem impedir fisicamente que os micróbios se decantem. Quando os micróbios se fixam às superfícies, alguns organismos quase imediatamente começam a produzir uma camada protetora de polissacarídeo comumente denominada biofilme ou lodo. Os aeróbios geralmente se desenvolvem nas camadas externas do biofilme (próximo ao fluido a granel), enquanto os anaeróbios crescem em áreas de baixa concentração de oxigênio, ou seja, na base do biofilme. O lodo aprisiona outros microrganismos, sedimentos, produtos de corrosão e detritos adicionais em águas industriais.
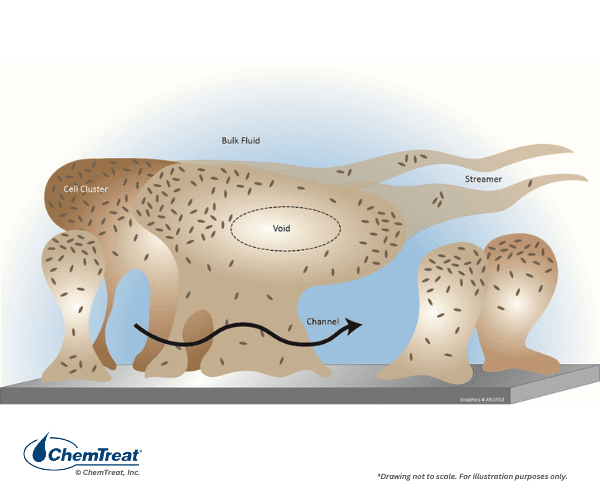
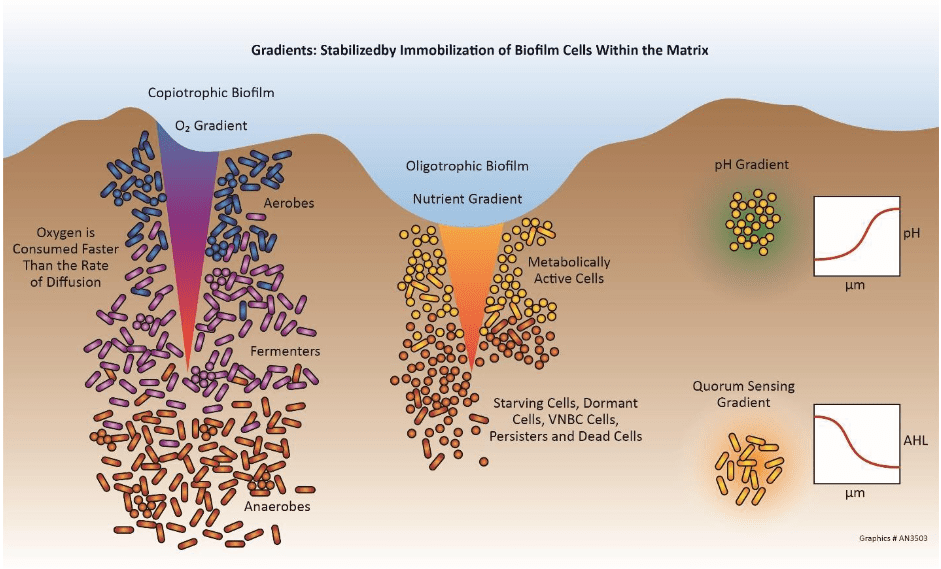

Crédito da foto: CBE-MSU Bozeman.
O biofilme protetor torna os microrganismos sésseis mais difíceis de matar do que os micróbios planctônicos. O trabalho do professor Phil Stewart na Montana State University mostrou que o movimento de qualquer molécula em um biofilme é limitado pela difusão e reatividade. Assim, a extensão da penetração do biocida é limitada pela reatividade da molécula em relação ao lodo protetor. Examinaremos esses conceitos em breve. Idealmente, o sistema de alimentação de biocidas de água de resfriamento/serviço de uma planta foi projetado e é operado adequadamente para matar organismos planctônicos antes que possam estabelecer colônias. No entanto, muitas vezes a equipe da planta deve lidar com o tratamento de colônias bem estabelecidas.
Formas de vida mais altas – Ameba e protozoários
Como observado anteriormente, se as colônias microbiológicas se tornarem bem estabelecidas, muitas vezes surgem formas de vida mais elevadas. Ameba e protozoários são micróbios eucarióticos unicelulares onipresentes. A célula protozoária pode ter apêndices especializados, como cílios ou flagelos, para movimento.
Embora muitos tipos de ameba possam causar problemas de saúde humana, é bem conhecida a relação entre ameba, protozoários e bactérias Legionella . Legionella é o organismo descoberto pela primeira vez em 1976, quando infectou pessoas que participaram de uma convenção da Legião Americana na Filadélfia. Quase três dúzias de pessoas morreram e muitas outras ficaram doentes. Foi rastreado até o vapor de água contendo as bactérias na pluma de exaustão de uma torre de resfriamento no telhado do hotel da convenção. O vapor entrou na entrada de uma unidade de tratamento de ar e se espalhou pelo hotel.
A literatura científica contém um fascinante corpo de evidências que documenta a relação entre Legionella e ameba. A ligação entre Legionella e amebae foi demonstrada pela primeira vez por Rowbotham, que mostrou que amebae poderia servir como hospedeiros para a Legionella. Logo depois, Kurtz descreveu o isolamento de amebae em águas de resfriamento que contêm Legionella, dando mais apoio à teoria de Rowbotham sobre a relação entre as duas. Um relatório posterior da Rowbotham ofereceu então um mecanismo para o crescimento e proliferação de Legionella dentro das espécies de amebae, Acanthamoeba polyphaga.
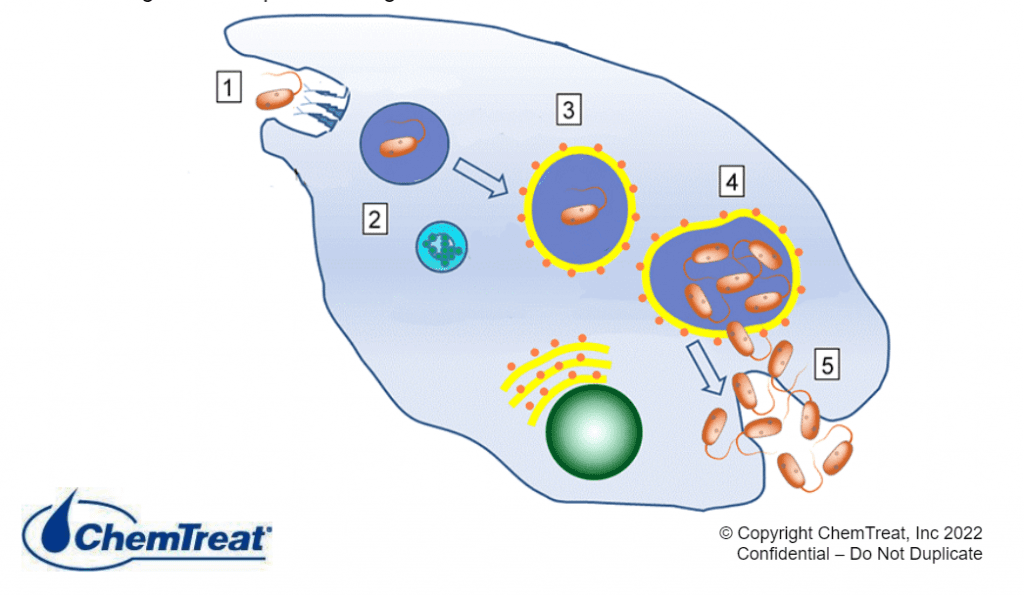
Muitos relatórios surgiram sobre mecanismos de crescimento de Legionella e liberação desses organismos mais elevados, mas o resultado é que o projeto e a operação adequados do sistema de alimentação de biocidas são fundamentais para minimizar todas as formas de incrustação microbiológica. Outra medida importante é encontrar e eliminar toda a tubulação de perna morta. Água estagnada pode permitir que os organismos se proliferem.
Ameba e protozoários são muito mais resistentes aos efeitos biocidas dos halogênios do que os micro-organismos mais simples, mas são suscetíveis a vários biocidas não oxidantes comumente usados.
Macroincrustação
A incrustação de superfícies por organismos maiores do que bactérias ou fungos é considerada macroincrustação. Os organismos comuns são mexilhões, mariscos e baráculos.
Os mariscos da água doce se tornaram problemáticos nos Estados Unidos no final da década de 1970, quando o marisco asiático, Corbicula flominea, entrou no país. Por volta de 1986, Dreissena polymorpha, o mexilhão da zebra, foi introduzido nos Grandes Lagos. Esses mexilhões são nativos da área do Mar Negro e Cáspio e podem atingir densidades de até 700.000 indivíduos por metro quadrado.

Ambos os organismos apresentam desafios significativos para a ingestão de água e sistemas, mas os mexilhões de zebra têm sido o foco principal nos últimos anos após sua disseminação dos Grandes Lagos por meio de vários canais no leste e meio-oeste dos Estados Unidos.
Controle microbiológico
Como uma observação preliminar para a seguinte discussão sobre biocidas de água de resfriamento, muitos países, incluindo os Estados Unidos, Canadá e México, colocaram limites no uso de compostos antimicrobianos em ambientes industriais. O registro do produto é necessário, o que normalmente vem com limitações sobre como e onde o produto pode ser aplicado. Produtos com o mesmo tipo e nível de componentes ativos, mas com nomes comerciais diferentes, exigem registro como entidades separadas. Nos Estados Unidos, os registros se enquadram na jurisdição da Agência de Proteção Ambiental (EPA) e da Lei Federal de Inseticidas, Fungicidas e Rodenticidas (FIFRA).
Além do registro federal, regulamentações estaduais/territoriais/provinciais adicionais podem ser colocadas no uso de produtos antimicrobianos. A maioria das empresas, especialmente instalações maiores, também exige processos finalizados antes que um novo produto químico possa ser aplicado. As plantas também devem cumprir os limites de descarga para alguns compostos. Nos EUA, esses regulamentos estão sob os auspícios do Sistema Nacional de Eliminação de Descarga de Poluição (National Pollution Discharge Elimination System, NPDES) criado dentro da Lei de Água Limpa (Clean Water Act, CWA) de 1972. Os regulamentos exigem permissões aprovadas antes que um fluxo de água com produtos químicos de tratamento, incluindo biocidas, possa ser descarregado no meio ambiente. Os estados individuais devem aplicar os regulamentos do NPDES, mas são livres para impor diretrizes mais rigorosas, se desejado.

O SpecOx® é o programa exclusivo de oxidantes especializados da ChemTreat, que fornece controle microbiano aprimorado em águas de resfriamento e de processo.
Biocidas oxidantes e não oxidantes
Para a grande maioria das águas de recirculação e de resfriamento de passagem única, os biocidas oxidantes são a espinha dorsal do programa de controle microbiano, pois a química geralmente representa o método mais econômico para manter a limpeza do sistema. Sistemas mais difíceis de tratar também podem se beneficiar de um biocida não oxidante suplementar e/ou da adição de um biopenetrante/biodispersante. Os compostos mais comuns em cada categoria são discutidos abaixo.
Biocidas oxidantes
Várias referências sugerem 1893 como o ano em que o cloro foi aplicado pela primeira vez como biocida de água potável, com rápido desenvolvimento da tecnologia no início do século XIX.
O gás cloro foi o cavaleiro para o tratamento de água potável e depois água de resfriamento por muitos anos. Cilindros de uma tonelada tornaram-se o método de armazenamento em muitas instalações, água potável e outros. Quando o cloro é adicionado à água, ocorre a seguinte reação:
- Cl2 + H2O - HOCl + HCl | Eq. 7-29
O HOCl, ácido hipocloroso, é o agente de morte e funciona penetrando nas paredes celulares e, em seguida, oxidando os componentes celulares internos. A eficácia e o poder de morte deste composto são muito influenciados pelo pH devido à natureza de equilíbrio do HOCl na água, conforme mostrado abaixo.
- xHOCl - H+ + OCl- | Eq. 7-30x
O OCl- é um biocida muito mais fraco do que o HOCl, provavelmente porque a carga no íon OCl- não permite que ele penetre efetivamente nas paredes celulares. A dissociação do ácido hipocloroso aumenta drasticamente em relação ao aumento do pH.
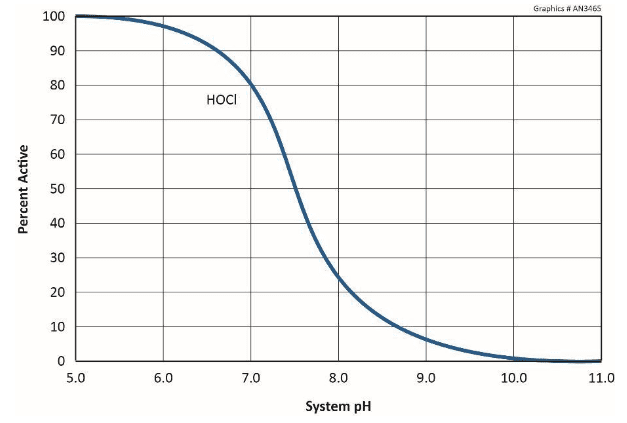
Como muitos programas de tratamento de corrosão/incrustação de torre de resfriamento operam em pH alcalino, muitas vezes próximo ou ligeiramente acima de 8,0, a química de cloro linear pode não ser a melhor escolha.
Devido a problemas de segurança com cloro gasoso, muitas instalações industriais mudaram para hipoclorito de sódio líquido (NaOCl, também conhecido como alvejante), com uma concentração de cloro ativo comum de 12,5%. O alvejante geralmente contém uma pequena quantidade de hidróxido de sódio, portanto, quando é injetado no fluxo de água de resfriamento, ele aumenta o pH, talvez apenas ligeiramente. No entanto, se a água for alcalina para começar, a maior parte do reagente existirá como o íon OCl–. Uma alternativa é a geração de hipoclorito no local, que provou ser eficaz em algumas aplicações.
Demanda de cloro
Como um oxidante forte, o ácido hipocloroso pode reagir com compostos que estão frequentemente presentes na recirculação de águas de resfriamento e de processo. Os mais proeminentes são amônia e orgânicos. A soma dessas reações não antimicrobianas é chamada de “demanda de cloro”. As reações consomem biocidas e reduzem a concentração disponível para atacar micróbios. Algumas reações também podem produzir orgânicos halogenados, cuja concentração de descarga pode ser regulada.
Alternativas de cloro
Como foi observado, o poder de eliminação do cloro diminui com o aumento do pH. Uma resposta popular para essa dificuldade tem sido a química do bromo, onde um oxidante de cloro (alvejante é a escolha comum) e brometo de sódio (NaBr) são misturados em um fluxo e injetados na água de resfriamento. A reação produz ácido hipobromoso (HOBr), que tem poderes de extermínio semelhantes ao HOCl, mas funciona de forma mais eficaz em pH alcalino.
- HOCl + NaBr - HOBr + NaCl | Eq. 7-31
Como o ácido hipocloroso, o ácido hipobromoso é um oxidante forte que também tem uma demanda de halogênio. No entanto, ao contrário do cloro que reage irreversivelmente com a amônia, a reação bromo-amônia é reversível e, portanto, deixa o bromo livre para atividade em direção aos micróbios.
Estabilizadores de halogênio
Existem vários compostos químicos disponíveis que podem estabilizar o cloro e o bromo e, em seguida, liberar os oxidantes gradualmente e onde eles são mais necessários. O halogênio estabilizado normalmente exibe uma potência oxidante menor quando comparado com o halogênio precursor, mas essa oxidação reduzida realmente oferece benefícios em relação ao controle microbiano, pois reduz reações indesejáveis com o lodo protetor.
Três classes de estabilizadores dominam o mercado: sulfamato, dimetil-hidantoína e isocianuratos.
A estrutura do sulfamato é mostrada abaixo.
Os halogênios estabilizados com sulfato talvez sejam os compostos mais comuns desse tipo. Eles estão disponíveis na forma líquida e são oferecidos principalmente como misturas de espécies de bromo e cloro.
Outra opção são as espécies estabilizadas de cloro e bromo dimetil-hidantoína.
Esses compostos estão disponíveis na forma de comprimidos/discos, grânulos e pós. Cada produto tem características de dissolução individuais, o que requer uma avaliação cuidadosa ao selecionar um sistema de alimentação. Um projeto comum para a alimentação de produtos sólidos é um pequeno recipiente no qual os comprimidos/discos podem ser carregados e que, em seguida, se dissolvem gradualmente em um fluxo de água de resfriamento que retorna ao sistema principal. Também são possíveis sistemas líquidos que produzem hidantoína estabilizada sob demanda através da reação do hipoclorito de sódio com dimetilhidantoína líquida.
Completando o trio de classes de halogênio estabilizado estão os isocianuratos, disponíveis principalmente como sólidos. As formulações sólidas são bastante estáveis, permitindo um longo prazo de validade.
Problemas de compatibilidade
Muitas das mesmas limitações para cloro e bromo existem para os halogênios estabilizados. Os produtos devem primeiro ser misturados com água, e não diretamente com outros produtos químicos que possam causar contaminação ou reações adversas. Formulações de produtos líquidos frequentemente introduzem alguma causticidade na água.
Dióxido de cloro
O dióxido de cloro (ClO2) é um gás em temperatura ambiente que é estável e solúvel em água até uma concentração máxima de aproximadamente 3.000 ppm. Ele deve ser preparado no local através da reação de clorito de sódio (NaClO2) ou clorato de sódio (NaClO3) com um agente oxidante adicional em condições ácidas. O dióxido de cloro é mais caro do que os halogênios, mas as técnicas de produção modernas reduziram o custo.
O estado de oxidação do cloro na molécula de ClO2 é +4, tornando-o bastante reativo a muitos compostos. No entanto, o dióxido de cloro exibe um alto grau de seletividade de reação e pode penetrar biofilmes para atacar micróbios. A seletividade é vantajosa para outras aplicações de tratamento de água, incluindo destruição de fenol de águas residuais e controle de odor.
Como o dióxido de cloro existe como um gás na solução, ele é facilmente removido por aeração. O ClO2 deve ser introduzido abaixo da superfície das águas receptoras para minimizar perdas. O manuseio dos precursores químicos para dióxido de cloro, que pode incluir ácido sulfúrico, requer atenção à segurança, embora geradores modernos de ClO2 sejam normalmente projetados com a segurança em mente. A adesão estrita às diretrizes operacionais é importante.
Cloraminas
As cloraminas servem para o controle microbiano em sistemas de água industriais há mais de um século. Em água contendo amônia, a alimentação contínua de cloro produzirá uma série de cloraminas, começando a partir de monocloramina (NH2Cl), depois dicloramina (NHCl2) e, finalmente, tricloreto de nitrogênio (NCl3). A solução atinge o “ponto de corte” quando toda a amônia tiver sido consumida, sobre a qual o cloro livre aparece.
A monocloramina é o composto de interesse para o controle de bioincrustação moderno, e as tecnologias agora estão disponíveis para produzir um fluxo puro de NH2Cl para este propósito. Quando comparada com hipoclorito de sódio, a monocloramina é menos reativa, mas quase equivalentemente tóxica. A reatividade reduzida permite penetrar biofilmes e atacar organismos subjacentes. No entanto, a monocloramina geralmente precisa de um tempo de contato mais longo do que o hipoclorito para alcançar a destruição microbiana desejada.
Oxidantes de peróxido: Peróxido de hidrogênio, ácido peracético, ácido percarbônico
Vários biocidas/desinfetantes à base de peróxido estão no mercado e todos podem produzir o radical peróxido (OH∙) como composto reativo. Os produtos mais comuns são peróxido de hidrogênio, ácido peracético e ácido percarbônico.
Ao contrário do dióxido de cloro, os peróxidos reagem indiscriminadamente com uma ampla gama de compostos, incluindo micróbios. A reação ocorre na parede celular e o dano causa lise celular e morte. Ao contrário dos halogênios, o oxigênio é o subproduto de reações ou autodecomposição do biocida. Um benefício secundário é que a liberação de oxigênio pode transformar a água de condições anaeróbicas em aeróbicas.
Uma desvantagem dos biocidas/desinfetantes à base de peróxido é o potencial de desativação de micróbios produtores de catalase. A catalase é uma enzima que todas as células vivas produzem para proteção contra o peróxido de hidrogênio gerado metabolicamente. No entanto, alguns micróbios produzem grandes quantidades dessa enzima e aumentarão a produção quando altos níveis de H2O2 estiverem presentes. Isso torna problemático o uso prolongado de peróxido como desinfetante. No entanto, para limpeza periódica off-line, o peróxido é extremamente eficaz na remoção de biofilmes e outros depósitos orgânicos, especialmente quando usado em combinação com soda cáustica, surfactante e em temperaturas quentes.
Biocidas não oxidantes
Embora os produtos químicos oxidantes normalmente sirvam como a base dos programas de biocidas de água de resfriamento, os micro-organismos podem desenvolver imunidade parcial, em grande medida a partir dos biofilmes protetores. Consequentemente, em algumas aplicações, a alimentação de um biocida não oxidante periodicamente, por exemplo, uma ou duas vezes por semana por uma hora ou mais, pode ajudar a controlar o crescimento microbiano. Enquanto os biocidas oxidantes normalmente danificam as paredes celulares, os não oxidantes penetram nas paredes celulares para então reagir com compostos dentro da célula que são necessários para a vida. As próximas seções examinam vários dos não oxidantes mais comuns.
Bronopol
Bronopol é um diol halogenado que contém um átomo de carbono eletrofílico. É amplamente usado em aplicações de tratamento de água e, como a 2,2-dibromo-3-nitrilopropionamida abaixo, tem visto aplicações limitadas no campo petrolífero. Bronopol é particularmente eficaz contra bactérias Pseudomonas. O composto parece funcionar por meio de diferentes mecanismos químicos, dependendo se as condições são aeróbicas ou anaeróbicas. Bronopol não é um biocida de ação rápida. O composto pode liberar formaldeído após a decomposição, mas o formaldeído não é responsável por suas propriedades biocidas.
Bronopol hidrolisará em soluções aquosas em taxas variáveis, dependendo do pH. A taxa de hidrólise é muito mais rápida em pH alcalino. O aumento da temperatura aumenta a taxa de hidrólise em um determinado pH. A faixa de pH ideal para a eficácia do bronopol é de 5–9. O composto reagirá e será desativado por sulfetos e sequestrantes de oxigênio à base de bissulfito. Por fim, o bronopol tem o potencial de liberar nitrito que, na presença de aminas secundárias, pode formar nitrosoaminas.
Figura 7.71. Estrutura do DBNPA.
O DBNPA é uma amida halogenada amplamente usada no tratamento de água e em aplicações de papel e celulose. No campo petrolífero, o DBNPA serve para tratar água de reposição para fluidos de fraturamento. A ação biocida do DBNPA é muito rápida e as concentrações residuais rapidamente hidrolisam para subprodutos menos tóxicos. A hidrólise rápida pode ser vantajosa se o fluxo de águas residuais for descarregado através de um tanque de retenção, permitindo que o residual se decomponha sem a necessidade de um produto químico de desativação. O DBNPA provou ser eficaz no controle da incrustação microbiológica em sistemas de água de reposição de alta pureza, particularmente unidades de osmose reversa.
A presença de dois átomos de bromo no segundo carbono de DBNPA torna o sítio muito eletrofílico, que então reage com os aminoácidos nucleofílicos contendo enxofre, metionina e cisteína, em células microbianas. A reação é irreversível e o resultado é a inativação da proteína que contém esses aminoácidos. A morte celular acontece.
A faixa de pH ideal para eficácia máxima de DBNPA é de 4 a 8. A taxa de hidrólise aumenta com o aumento do pH, e o composto perde rapidamente a potência acima de 8 pH. A hidrólise também aumenta com o aumento das temperaturas. O DBNPA é desativado por sequestrantes de oxigênio à base de sulfetos e bissulfito. O composto não é estável à luz UV e reage com amônia.
Glutaraldeído
O glutaraldeído tem visto um uso extensivo em aplicações de tratamento de água industrial, incluindo operações de petróleo e gás, a indústria de papel e para esterilização de instrumentos médicos. O produto químico reage com dois dos vinte aminoácidos essenciais, lisina e arginina, necessários para a função celular. A eficácia é ideal dentro de uma faixa de pH de 7–10, mas o composto é mais estável em um pH ácido. O glutaraldeído reagirá com sequestrantes de oxigênio à base de bissulfito para formar um produto de adição de aldeído-bissulfito. Essa reação é reversível e, em temperaturas elevadas (> 60 °C), o complexo se decompõe para liberar o glutaraldeído. A reação do glutaraldeído com aminas ou íons de amônio não é reversível e produz um subproduto com pouca ou nenhuma eficácia biocida.
Isotiazolonas
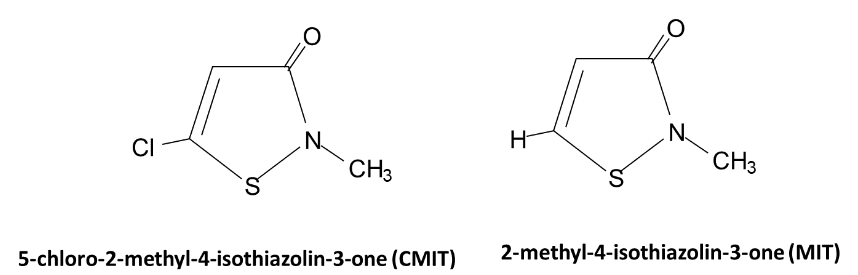
Além das aplicações em água de resfriamento, as formulações de isotiazolina são, em concentrações muito leves, um agente antimicrobiano comum em muitos detergentes. A formulação biocida à base de isotiazolona mais comum para o tratamento de água de resfriamento tem uma mistura de 3:1 de CMIT e MIT. As concentrações de CMIT e MIT em produtos registrados são de 1,5% ou 4% de ingrediente ativo. Vários estabilizadores fazem parte de formações industriais, incluindo nitrato cúprico, nitrato de magnésio e iodato de potássio. Também está disponível um produto ativo de 1,5% estabilizado com bronopol. A seleção adequada do produto é frequentemente influenciada pelo estabilizador. As isotiazolonas são bactericidas de amplo espectro, mas de ação lenta, que também mostram boa reatividade contra fungos.
Tanto o CMIT quanto o MIT são incompatíveis com sulfeto de hidrogênio ou outros nucleófilos à base de enxofre. Portanto, se bactérias redutoras de enxofre (SRB) estiverem presentes, as isotiazolonas podem não ser a melhor escolha não oxidante. pH elevado (> 9,5) reduzirá o CMIT, mas o MIT é estável em um pH acima de 10. As isotiazolonas podem ser desativadas com bissulfito de sódio em uma razão molar de 2:1 para isotiazolona.
Aminas quaternárias
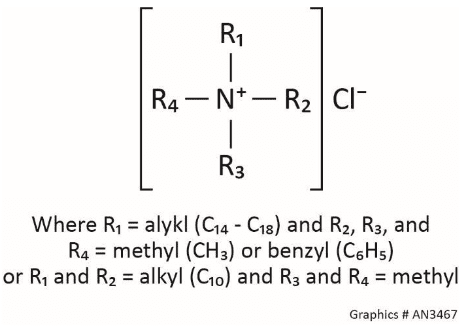
As aminas quaternárias, ou “quats”, como são comumente denominadas, têm sido amplamente utilizadas em uma ampla variedade de aplicações de água de resfriamento e de processo. As moléculas são carregadas positivamente, com quatro grupos alquil ligados a um átomo de nitrogênio central. Um ou mais dos grupos alquil consistem em uma cadeia de metil, benzil, decil (C10), coco (C14) ou soja (C18). Os amêijoas são comumente alimentados em combinação com outros biocidas e geralmente são muito econômicos. Alguns compostos também servem como inibidores de corrosão de amina de película.
As amônias quaternárias têm propriedades surfactantes que solubilizam as membranas celulares, levando a danos celulares e morte. Os compostos são especialmente eficazes quando usados em combinação com outros biocidas que também atacam as paredes celulares.
Espuma é uma preocupação com aminas quaternárias. As espumas quat de cloreto de alquildimetilbenzil amônio (ADBAC) extensivamente, mas compostos de baixa espuma, como cloreto de didecildimetil amônio (DDAC), estão agora disponíveis. A formação de espuma pode ser problemática em sistemas de água do mar, onde a espuma pode interferir na operação de torres de desaeração. As propriedades surfactantes dos quats podem inibir a separação de emulsões óleo/água em sistemas de produção de campos petrolíferos. A água dura pode diminuir a atividade biocida dos quats, e os quats podem reagir com inibidores de incrustação e corrosão carregados negativamente, o que reduz a eficácia.
Sulfato de tetraquishidroximetilfosfônio (THPS)
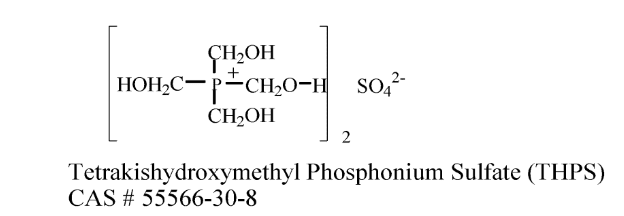
O THPS é empregado principalmente em aplicações em campos petrolíferos, mas também tem sido usado em sistemas tradicionais de tratamento de água, bem como em algumas aplicações não biocidas. Um produto intimamente relacionado, o cloreto de tetraquishidroximetilfosfônio (THPC) é um retardante de chama comum. O THPS é único, pois matará microrganismos, reduzirá as concentrações de sulfeto de hidrogênio e reagirá e dissolverá o sulfeto de ferro.

TÉCNICAS MODERNAS PARA PROTEÇÃO CONTRA CORROSÃO/INCRUSTAÇÃO EM TORRES DE RESFRIAMENTO DE MÉDIO PORTE
Limpeza e sanitização de agentes microbiológicos poluentes
A evolução do enchimento do filme da torre de resfriamento de alta eficiência levou a uma melhoria significativa no desempenho da torre. No entanto, como já foi observado, com o aumento da área de superfície do enchimento de alta eficiência, vem o aumento do potencial de formação de incrustação e incrustação. O melhor método para limpar o enchimento da torre depende de vários fatores, incluindo preocupações de segurança, metalurgia do sistema, limpeza em serviço vs. fora de serviço, impacto potencial nas operações da fábrica, opções de descarte para a solução de limpeza, impacto no meio ambiente e a natureza química e física do incrustante.
Balanças minerais
Depósitos minerais duros consistem mais comumente em sílica/sílicatos ou carbonato de cálcio (calcita). A solubilidade da sílica é proporcional à temperatura, e depósitos frequentemente se formam perto do fundo do pacote de enchimento de contrafluxo, onde a temperatura da água de resfriamento é mais baixa, os sólidos dissolvidos são mais concentrados e a distribuição desigual de água/ar pode levar a manchas secas. Água com temperatura mais alta no topo do enchimento tem a menor solubilidade de calcita e promove uma cinética de deposição mais rápida. No entanto, à medida que a água passa pelo enchimento, os minerais são ligeiramente concentrados por evaporação, e o pH aumentará ligeiramente à medida que o excesso de CO2 é removido.
Uma técnica que pode ser eficaz em incrustações duras nos estágios iniciais de deposição é aplicar surfactantes especiais que penetram nos depósitos e induzem a descamação do substrato plástico ligeiramente flexível. O surfactante é normalmente aplicado com o programa de inibidor de incrustação normal por um período prolongado de 60-180 dias. O tratamento pode remover até 70–80% dos depósitos. Antes da limpeza, é imperativo identificar e corrigir as condições de formação de incrustação.
Para grandes sistemas de resfriamento, onde a escala predominante é a calcita, o enchimento pode ser limpo ao longo do tempo, reduzindo o pH operacional e/ou ciclos de concentração até que a água esteja abaixo da saturação de calcita. O Calcite frequentemente serve como aglutinante para a matriz de depósito, de modo que a dissolução do carbonato de cálcio pode ser bastante eficaz na separação de todo o depósito. O ácido sulfúrico é uma escolha óbvia para sistemas que já o têm para controle de pH. Compostos menos corrosivos incluem ácidos orgânicos ou ácido sulfâmico inibido. Alguns ácidos orgânicos são mais eficazes do que os ácidos minerais em pH intermediário e são sinérgicos ao ácido sulfúrico. Em pH 5, a aplicação de um ácido orgânico apropriado acelerará a taxa de dissolução da calcita em 10 a 20x em comparação com o ácido sulfúrico isolado.
Para descamação predominantemente leve de carbonato de cálcio, a limpeza com espuma ácida off-line foi empregada com sucesso, pelo menos em torres de resfriamento menores. Quando aplicada por especialistas habilidosos no topo do enchimento, a passagem lenta da espuma através do enchimento fornece tempo prolongado para a escala de ácido para contato. O volume relativamente baixo de solução de limpeza de espuma gasta e principalmente neutralizada pode ser potencialmente coletado no reservatório para descarte, ou talvez misturado com água circulante de células de torre em serviço vizinhas. Tal mistura está sujeita aos requisitos ambientais e de segurança da fábrica.
As incrustações minerais também podem ser removidas mecanicamente, até certo ponto, in situ ou ex situ . De acordo com a natureza quebradiça da balança em relação ao material de enchimento de PVC flexível, alguns depósitos podem normalmente ser desalojados por limpeza mecânica por baixo.
Matrizes de depósito microbiológico/orgânico
Depósitos onde micróbios ou orgânicos servem como aglutinante para a matriz de depósito são caracterizados por uma consistência macia, muitas vezes semelhante à lama. Ao contrário das incrustações minerais, os depósitos microbiológicos tendem a se acumular principalmente no meio do enchimento. As velocidades da água diretamente sob os bicos de pulverização são geralmente altas o suficiente para inibir a adesão microbiana na camada superior. Por esse motivo, a incrustação microbiológica às vezes não é detectada porque não é visível de cima. À medida que a velocidade da água diminui dentro do enchimento, os micro-organismos começam a colonizar as superfícies de enchimento, atuando como um filtro para sólidos suspensos. A incrustação tende a ser mais intensa no meio do que na parte inferior, porque as últimas polegadas de enchimento não suportam fisicamente um depósito espesso e macio. A incapacidade de visualizar claramente a deposição microbiológica de cima ou de baixo, combinada com a dificuldade de inspecionar as camadas de enchimento intermediárias, muitas vezes permite que a incrustação progrida sem ser detectada até atingir um estágio avançado. Várias técnicas foram elaboradas para monitorar áreas suscetíveis, incluindo a suspensão de seções de preenchimento de células de carga; cortar uma janela de acesso na carcaça da torre para permitir que uma seção intermediária seja removida periodicamente para inspeção; suspender uma seção de preenchimento abaixo do preenchimento principal para permitir que ela seja facilmente inspecionada e pesada. Cada método foi parcialmente bem-sucedido, mas nenhum provou ser totalmente satisfatório.
Existem vários métodos para remover depósitos de sedimentos biológicos do enchimento da torre de resfriamento. A hiperhalogenação é uma técnica comum, mas os resultados são frequentemente decepcionantes. A corrosão potencial dos componentes do sistema e a necessidade de descloração antes da descarga são questões importantes adicionais ao considerar este método.
Depósitos microbiológicos normalmente têm alto teor de água e encolherão e se soltarão das superfícies quando completamente secos. No entanto, secar efetivamente o enchimento da torre de resfriamento pode ser problemático, mesmo com a ajuda de ventiladores, e mesmo se a torre estiver localizada em um clima de baixa umidade. O dióxido de cloro também tem sido usado como um limpador para biofilmes de torres de resfriamento com algum sucesso. O método de limpeza mais amplamente praticado e eficaz para depósitos com aglutinantes microbiológicos ou orgânicos é o peróxido de hidrogênio (H2O2) devido à sua força oxidante e à ação física das microbolhas de oxigênio produzidas à medida que reage com depósitos orgânicos. Os aspectos ambientais positivos do peróxido de hidrogênio, desde a rápida quebra até água e oxigênio, e sua facilidade de aplicação são fatores adicionais que favorecem o peróxido como um limpador de preenchimento. As dosagens típicas estão na faixa de 500 a 3.000 ppm de H2O2 ativo. A adição de surfactantes em baixas concentrações ajudará a soltar depósitos. Dispersantes poliméricos são frequentemente incluídos para manter sólidos em suspensão para descarga de águas residuais. Os procedimentos de descarte devem ser bem estabelecidos para lidar com a descarga dessas águas normalmente turvas.
As Figuras 7.76 a e b abaixo ilustram a aparência de depósitos de lodo-silte em enchimento de torre de resfriamento de alta eficiência moderadamente incrustado antes e depois da limpeza.


Nos casos em que o depósito contém uma alta porcentagem de inorgânicos, a água circulante pode se tornar altamente turva. Os procedimentos do projeto devem incluir disposições para o descarte de águas residuais turvas após o processo de limpeza.
Dispersantes para ajudar na limpeza de depósitos microbianos
Nos casos em que a bioincrustação de uma torre de resfriamento ou trocador de calor não requer uma limpeza off-line, a alimentação biodispersante suplementar com biocida(s) pode ser suficiente para manter o equipamento limpo e as condições limpas.
Um biodispersante eficaz com suas propriedades surfactantes pode ajudar a evitar a fixação microbiana às superfícies ou pode facilitar a remoção de depósitos. Vários tipos de surfactantes estão disponíveis, incluindo sulfonatos aniônicos de alquilbenzeno, poliglicosídeos de alquila e polímeros não iônicos de óxido de etileno/óxido de propileno (EO/PO).
Os compostos aniônicos mais comuns são compostos que impedem a aglomeração de partículas menores ao absorver em superfícies de partículas, aumentando assim a carga de superfície negativa e a repulsão de partículas. Como esses dispersantes têm uma carga negativa, eles podem interagir com espécies catiônicas na água (especialmente cálcio em torres de resfriamento altamente cicladas) e perder a eficácia.
Biodetergentes são tipicamente moléculas não iônicas que não reagirão com outros compostos de tratamento de água. Eles exibem boa eficiência em águas duras e são compostos estáveis.
O papel do dispersante não é matar micróbios, mas auxiliar na remoção de depósitos. A concentração inicial de dispersante depende da extensão das colônias existentes e será maior do que as dosagens de manutenção subsequentes. O dispersante deve ser injetado antes do tratamento com biocidas, para que possa condicionar os biofilmes e aumentar a eficácia do agente(s) de eliminação. Como ocorre com qualquer surfactante, existe o potencial de formação de espuma, portanto, devem ser implementados procedimentos para combater problemas de formação de espuma. Além disso, a escolha do dispersante pode ser influenciada pela toxicidade ambiental do produto químico e pela regulação potencial na permissão de descarga.
Dispositivos de tratamento não químico
Embora os programas tradicionais de tratamento de água dependam de vários produtos químicos para controlar incrustações, corrosão e incrustação microbiológica em sistemas de água industriais, algumas empresas comercializam tecnologias não químicas como alternativas ecológicas ou ecológicas. Exemplos incluem dispositivos magnéticos, sistemas de energia pulsada, sistemas eletrostáticos, instrumentos ultrassônicos e sistemas de cavitação hidrodinâmica. Os fabricantes afirmam que os dispositivos podem substituir os tratamentos químicos tradicionais.
No início, essas reivindicações não foram rigorosamente testadas para determinar se os dispositivos eram realmente capazes dos recursos anunciados. No entanto, no abril 2010, a Sociedade Americana de Engenheiros de Aquecimento, Refrigeração e Ar Condicionado (American Society of Heating, Refrigerating and Air-Conditioning Engineers, ASHRAE) publicou um relatório de pesquisa sobre várias dessas tecnologias em torres de resfriamento piloto. Embora os fornecedores de ímãs muitas vezes não façam alegações sobre o controle microbiológico, os outros frequentemente alegam redução da incrustação microbiológica. O relatório da ASHRAE indicou que nenhum dos dispositivos físicos de tratamento de água reduziu as populações microbiológicas nos sistemas de torre de resfriamento piloto, enquanto os tratamentos tradicionais à base de cloro foram eficazes. Um estudo subsequente (referência 24) confirmou que esses mesmos dispositivos não químicos não puderam reduzir a Legionella planctônica ou séssil ou populações microbiológicas gerais em torres piloto.
Um método não químico que demonstrou um grau significativo de controle microbiano da água de resfriamento é a luz ultravioleta (UV). Essa tecnologia continua a melhorar, e o trabalho recente mostrou que os raios UV são especialmente eficazes (com projeto de sistema adequado) para controle de macroincrustação. Uma preocupação principal com UV é a capacidade de fornecer energia suficiente de forma confiável para grandes volumes de água ou até que ponto a penetração de UV é influenciada pela clareza da água. Por exemplo, a turbidez de sólidos suspensos pode proteger os micro-organismos da energia UV. As diretrizes recomendadas para a seleção de UV como parte de um programa de controle microbiológico são:
- Turbidez: <5 NTU
- TSS: < 10 mg/l
- A dureza total normalmente na faixa de 125 a 200 mg/L ou abaixo dela, uma vez que a incrustação da dureza nas luvas de quartzo das lâmpadas pode influenciar a transmitância
- Faixa de pH: 6,0–9,0
A dosagem de UV é proporcional à intensidade multiplicada pelo tempo de residência. A maioria dos micro-organismos pode ser destruída com uma dose UV de aproximadamente 10.000 μW-s/cm2. Uma recomendação comum é o desenho do sistema com uma dosagem UV de 30.000 μW-s/cm2.
Métodos de controle de macroincrustação
Organismos aquáticos como mexilhões de zebra, mariscos asiáticos e outros desenvolvem um casco completo à medida que atingem a maturidade e se fixam às superfícies, nas quais filtram a água em busca de nutrientes. Organismos adultos podem detectar biocidas oxidantes e “clam-up” por períodos prolongados até que a ameaça de toxicidade tenha passado. Se as colônias se estabelecerem, métodos mecânicos tediosos podem ser necessários para remover os organismos que, quando morrem, produzem odores extremamente desagradáveis. No entanto, os organismos podem ser destruídos mais prontamente no estágio larval, antes que as coberturas protetoras tenham se desenvolvido completamente. Esses organismos jovens são conhecidos como vegetarianos. As próximas seções examinam métodos químicos e físicos para controlar macro-organismos.
Controle químico: Biocidas oxidantes
O cloro é um biocida forte em relação aos vegetarianos e, embora muitas instalações estejam limitadas a duas horas de alimentação de cloro ou alvejante por dia, se o produto químico for consistentemente alimentado todos os dias, muitos vegetarianos sucumbirão. Em alguns casos, as fábricas receberam isenções de reguladores ambientais para alimentação contínua ao longo de várias semanas para matar organismos, a uma concentração comum de cloro residual livre de 0,2–0,5 ppm. Para o controle de mariscos asiáticos, a cloração contínua por quatro semanas na primavera e no outono durante os períodos de pico de geração pode ser eficaz. Com mexilhões de zebra, a cloração contínua durante o verão pode ser eficaz. No entanto, as permissões de alimentação contínua são frequentemente negadas por preocupações sobre a formação e descarga de compostos orgânicos halogenados, genericamente denominados trihalometanos (THM).
O bromo é mais tóxico para mariscos asiáticos adultos e jovens do que o cloro, e é um oxidante mais rápido, que melhora a aplicação intermitente. Além disso, o bromo geralmente decai mais rapidamente no ambiente e é menos corrosivo para cobre, ligas de cobre e aço inoxidável do que o cloro.
O tratamento contínuo com dióxido de cloro provou ser eficaz para o controle do mexilhão da zebra. O ClO2 requer dosagens mais baixas e tempos de exposição mais curtos do que o cloro. Uma concentração de 0,2 ppm oferece 100% de mortalidade por mexilhões de zebra em apenas oito dias em comparação com mais de três semanas ou mais para cloro. A 1,0 ppm residual, o ClO2 fornecerá 99% de mortalidade em uma exposição de quatro dias em comparação com 14 dias para cloro. Em temperaturas mais altas da água durante o verão, a toxicidade é aumentada e o tempo de morte reduzido. O tratamento intermitente com dióxido de cloro requer concentrações residuais mais elevadas. Uma grande vantagem do dióxido de cloro é a produção mínima de THMs em comparação com o cloro. As desvantagens incluem custos com produtos químicos e equipamentos e preocupações sobre armazenamento de produtos químicos. A desativação do dióxido de cloro residual e do clorito – um subproduto do processo – antes da descarga pode ser necessária para garantir a segurança aquática.
Biocidas não oxidantes
Vários biocidas não oxidantes são aprovados pela EPA para tratamentos de macroincrustação. Esses biocidas são compostos catiônicos que provaram ser eficazes na eliminação de mariscos e mexilhões. Eles incluem os compostos quaternários descritos anteriormente para controle microbiológico de incrustação.
Em comparação com oxidantes, os compostos não oxidantes não desencadeiam uma resposta nos moluscos e amêijoas e, portanto, os organismos continuam a filtrar a água e são expostos a dosagens químicas letais. Outra vantagem de um programa não oxidante é que os compostos não exigem geração no local e, portanto, os sistemas de alimentação podem ser facilmente instalados. A química não produz THMs, no entanto, os compostos oferecem risco ambiental e toxicidade potencial para outros organismos aquáticos. Assim, eles não podem ser legalmente utilizados sem a permissão dos reguladores ambientais da fábrica, com as condições escritas na permissão de descarga do NPDES da instalação. A permissão muitas vezes exigirá alimentação de argila ou bentonita para o fluxo de descarga para adsorver e desativar concentrações residuais. Além disso, como ocorre com qualquer produto químico, os procedimentos de segurança ao manusear não oxidantes são muito importantes. O pessoal da fábrica deve estar usando todos os equipamentos de proteção (EPI) necessários e deve seguir todos os procedimentos de manuseio da carta. As fichas de dados de segurança (FDS) devem estar disponíveis no local de alimentação, com uma segunda cópia localizada em um local central, como a sala de controle.
Métodos de controle físico
A maioria das entradas de plantas tem telas ou filtros para evitar que grandes detritos entrem no sistema de resfriamento, e essas telas podem impedir efetivamente a passagem de moluscos por adultos. No entanto, as telas ásperas fazem pouco para evitar a infiltração de vegetarianos e a subsequente formação de colônias. Os mexilhões da Zebra exibem mortalidade em temperaturas acima de aproximadamente 40 °C (104 °F), que tem sido ocasionalmente utilizada em fábricas com um arranjo de tubulação que permite a recirculação da descarga de água de resfriamento para a entrada. A técnica pode ser particularmente eficaz no inverno, quando os mexilhões são aclimatados à água fria. Outros métodos não químicos que forneceram resultados mistos incluem corrente elétrica, radiação de ionização e dessecação (secagem). Os mexilhões da Zebra podem viver até três semanas sem água, o que tem sido um fator em sua disseminação em grande parte do país. Eles se prendem a embarcações recreativas e, quando os barcos são transportados de um corpo de água para outro, os mexilhões infestam a nova fonte.
Nenhum método mecânico/físico único provou ser completamente eficaz no controle ou prevenção de macroincrustações, o que destaca a importância de programas de tratamento químico bem projetados e operados para minimizar essas pragas. Uma vez que as colônias sejam estabelecidas, pode ser necessário um desligamento da planta para removê-las mecanicamente.
Métodos de monitoramento microbiológico
Tanto os testes de campo quanto as análises do laboratório central são úteis para identificar micróbios e selecionar os programas corretos de tratamento químico. A identificação precisa de organismos pode ser particularmente importante para a seleção de biocidas não oxidantes. Também são importantes métodos para monitorar as concentrações de biocidas da água de resfriamento na água de resfriamento para garantir resíduos adequados. A importância do controle de colônias sésseis não pode ser superenfatizada.
Testes de campo de micróbios
Lâminas de mergulho
As lâminas de imersão consistem em um transportador de plástico que é revestido em dois lados com meio de cultura de ágar sólido que pode conter o mesmo meio ou meios diferentes em cada lado, cada um dos quais possui indicadores metabólicos (corantes).
O meio bilateral aumenta a variedade de micróbios que podem ser identificados, por exemplo, bactérias e fungos. Um período de incubação comum para lâminas de imersão é de dois dias na temperatura especificada pelo fabricante. A população planctônica pode então ser estimada comparando o tapete de micro-organismos que cresceram no nutriente do ágar com um gráfico de referência.
As vantagens das lâminas de imersão são a facilidade de uso e transporte. Uma dificuldade é que diferentes fabricantes de lâminas de imersão utilizam diferentes tipos de ágar, e alguns tipos podem não suportar o crescimento de bactérias específicas que estão presentes em muitos sistemas de água industriais.
Películas Petri
As películas de Petri são placas plásticas flexíveis que contêm ágar, nutrientes e corantes para tornar os micróbios prontamente visíveis. Devido ao seu tamanho fino e facilidade de manuseio, os filmes Petri são adaptáveis em campo ou em laboratório. Vários filmes de Petri estão disponíveis para identificação de micróbios específicos, incluindo bactérias aeróbicas, E. coli, leveduras, bolores e vários outros.

Análises de trifosfato de adenosina
A adenosina trifosfato (ATP) é o principal transportador de energia para todos os organismos vivos. Porque o ATP desempenha um papel fundamental e importante na produção de energia celular, regulação metabólica e sinalização celular; existem vários métodos para medir esse importante composto. Um método comum utiliza uma enzima dependente de ATP, a luciferase, para gerar luz. A luz é capturada por um detector conhecido como luminômetro. A reação quase imediata permite o cálculo quase instantâneo da concentração microbiológica. O procedimento envolve misturar uma amostra de água (alguns métodos dependem da concentração dos micróbios em uma amostra usando filtros de membrana) com um surfactante para lisar as células, liberando assim o ATP em solução. A luciferina e a enzima luciferase são então adicionadas com mistura completa, seguida por medição da luz.
Métodos baseados em laboratório
Abaixo estão breves descrições de alguns dos testes microbiológicos laboratoriais mais comuns.
Placas de ágar específicas
Placas de ágar são placas de Petri circulares contendo um meio gelatinoso enriquecido com nutrientes para apoiar o crescimento bacteriano. O próprio ágar pode ser feito no laboratório a partir de receitas e aplicado às placas. Placas de ágar pré-despejadas também estão disponíveis. As placas de ágar podem ser não seletivas para o crescimento geral ou podem conter ingredientes específicos que promovem o crescimento de um organismo alvo, como Pseudomonas ou Enterobacteriaceae.
Testes BART
Os testes de reação de atividade biológica (Biological Activity Reaction Tests, BARTs) são um método simples, em campo ou laboratório, de detectar certas bactérias em amostras de água. As amostras são incubadas durante vários dias. Cada BART tem um indicador visual exclusivo que permite ao usuário identificar a presença ou ausência de bactérias específicas. A população-alvo de micróbios é estimada a partir do número de dias de incubação até a cor ou turvação aparecer no tubo.

Os BARTs são eficazes para identificar bactérias relacionadas ao ferro, redutoras de sulfato, formadoras de lodo, nitrificantes e desnitrificantes. O método é basicamente um teste do tipo presença/ausência e não fornece dados populacionais. Os testes podem ser úteis em aplicações em campos petrolíferos para detecção geral de bactérias anaeróbicas sem a necessidade de equipamentos caros.
Citometria de fluxo
A citometria de fluxo é uma técnica de análise de partículas que usa luz laser para analisar características físicas e químicas de partículas em um fluxo de fluido. O tamanho e a quantidade de partículas suspensas são medidos pela análise do efeito eclipse que as partículas produzem à medida que passam na frente do laser. A quantidade de dispersão de luz está associada à complexidade das partículas. As partículas podem ser contadas e classificadas com base no tamanho e complexidade. Os benefícios da citometria de fluxo incluem a especificidade da análise, análise simultânea de uma amostra para vários tipos de bactérias e a capacidade de obter resultados em horas, em vez de dias. Essa tecnologia é empregada principalmente no setor médico.
Microscopia fluorescente – coloração viva/morta
A microscopia é um método bem estabelecido para analisar visualmente bactérias. A coloração fluorescente pode diferenciar várias bactérias e, com o uso de combinações de corantes, pode identificar bactérias vivas e mortas. A aplicação de corante vivo/morto em um biofilme pode ajudar a confirmar se o programa de tratamento químico é eficaz na penetração do biofilme e na eliminação das bactérias no interior. Embora a coloração viva/morta seja uma excelente técnica visual e ofereça um método rápido de análise de uma amostra, ela exige um microbiologista treinado, um ambiente controlado e instrumentação e reagentes especializados.
Análises de microrganismos sésseis
A maioria das técnicas listadas acima é para especiação de organismos planctônicos. Se colônias sésseis se desenvolverem e estiverem acessíveis durante inspeções off-line, os inspetores devem coletar amostras para análises laboratoriais. Eles podem fornecer informações precisas sobre os organismos que florescem nesse ambiente, o que, por sua vez, oferece orientação para modificações no programa de tratamento químico.
*Observação:para qualquer pessoa que possa entrar em contato com colônias sésseis ou respirar a atmosfera ao seu redor durante inspeções ou limpezas de trocadores de calor, existe o potencial de exposição a bactérias Legionella ou outros microrganismos prejudiciais. Equipamentos de proteção individual (EPI) adequados, incluindo máscaras faciais, são essenciais.
Monitoramento de biocidas oxidantes
A análise regular do resíduo de biocida oxidante é extremamente importante para garantir dosagens consistentes e adequadas.
O método DPD
Antes do desenvolvimento de métodos de monitoramento on-line, o procedimento padrão para medição de halogênio livre ou total foi o método DPD. DPD é o acrônimo para N,N-dietil-p-fenilenodiamina. Reage com oxidantes na água para formar um complexo colorido, cuja intensidade é diretamente proporcional à quantidade de oxidante presente.
É importante observar que a DPD reage com os oxidantes padrão, incluindo resíduos livres e combinados. A monocloramina é um excelente exemplo do último. Análises livres ou combinadas exigem um fator de multiplicação diferente para converter a cor observada para a concentração. Outra variável é o tempo de reação. Os resultados do teste de resíduos livres estão normalmente disponíveis em menos de 30 segundos, enquanto o teste de resíduos totais geralmente precisa de 3–6 minutos para a reação completa. Cada um requer um kit de teste separado. Embora ambos incluam DPD e um tampão de pH, o kit de resíduo total também inclui iodeto de potássio e um tampão adicional. Esses dois compostos aumentam a formação de cores e permitem que oxidantes menos reativos se combinem com a DPD.
Análise de cloro on-line
A medição de biocidas oxidantes maduros e on-line está disponível. Um instrumento padrão da indústria é mostrado abaixo.

O analisador extrai uma amostra e, de acordo com a discussão de DPD acima, injeta o corante e o tampão. Após o tempo de reação adequado, o instrumento exibe a concentração do oxidante, lava a amostra gasta e extrai uma nova amostra. Assim, o analisador pode fornecer análises 24 horas, separadas apenas pelo tempo necessário para a reação do reagente. O monitoramento on-line pode ser de grande benefício na detecção imediata de mau funcionamento do sistema de alimentação de biocidas ou alterações na química da água que aumentam a demanda por biocidas. Semelhante às análises DPD de coleta de amostra, um reagente residual livre ou total está disponível para o analisador.
Potencial de oxidação-redução
As águas de resfriamento normalmente contêm uma série de compostos oxidantes ou redutores. A medição do potencial de oxidação-redução (ORP) é uma técnica analítica que, como o próprio nome indica, fornece dados sobre a potência oxidante ou redutora da solução. Quando biocidas oxidantes são utilizados para controle microbiológico, seu potencial oxidante geralmente anula outras espécies.
As sondas ORP comuns normalmente têm um eletrodo ativo contendo fio de platina e um contraeletrodo vedado de prata/cloreto de prata. Essas sondas são bastante robustas e muitas vezes podem sobreviver por vários anos sob condições normais de operação com água de resfriamento e água de processo.
Existem algumas ressalvas com ORP para monitoramento de resíduos de biocidas. As medições não são lineares, especialmente em baixas concentrações. A temperatura influencia o ORP; e a compensação de temperatura, que requer uma sonda adicional, é importante para leituras precisas.
Mesmo com essas ressalvas, as medições de ORP ainda podem fornecer informações significativas sobre as concentrações de biocidas. Com um biocida oxidante presente, o ORP normalmente será elevado a partir dos valores basais para uma faixa de 300 a 700 mV, dependendo da espécie oxidante, concentração, temperatura, pH e presença de outras espécies. O ORP pode verificar se o oxidante está presente e também detectará se as condições passam de aeróbicas (ORP positivo) para anaeróbicas (ORP negativo). Tais alterações podem indicar influxo de contaminantes sérios.
Monitoramento de alimentação química, deposição e corrosão
As seções anteriores descreveram os mecanismos proeminentes de deposição e corrosão da água de resfriamento e os métodos de controle. As próximas seções descrevem técnicas de monitoramento de deposição e corrosão.
Monitoramento de Deposição
O Capítulo 6 ofereceu um método de monitoramento indireto; sendo a avaliação do desempenho do trocador de calor por meio de temperaturas de entrada, saída e fluido do processo; e a partir dessas e de outras leituras, cálculos on-line de transferência de calor. Por meio de algoritmos modernos, os dados podem ser continuamente analisados para permitir a detecção imediata da formação de incrustação ou incrustação microbiológica.
Cupons de depósito oferecem outra opção.

Esses cupons podem ser incluídos com cupons de corrosão em um sistema de amostragem bypass para coletar matéria suspensa e incrustações minerais. A extração periódica e os exames visuais fornecem dados sobre a formação de incrustações (ou falta dela). As medições de densidade de peso e análises laboratoriais da composição de depósito podem fornecer dados valiosos.
Fotografias dos cupons imediatamente após a extração são importantes para documentar as condições dos cupons. Um problema com os cupons é que não serem aquecidos, eles não atingem a temperatura da superfície dos tubos do trocador de calor e, portanto, a deposição ou corrosão pode ser mais suave do que realmente existe em alguns locais dentro do sistema. Duas ferramentas que simulam com mais precisão as condições reais são o monitor de deposição e o trocador de calor de teste.

Essas unidades contêm tubos de trocadores de calor removíveis. A alimentação é a água de retorno (quente) do sistema de resfriamento, com uma haste aquecida no compartimento de amostras. Essa configuração teoricamente coloca a amostra do tubo sob o maior estresse de qualquer trocador de calor em todo o sistema de resfriamento. Se houver condições de incrustação, a deposição deve ocorrer primeiro na unidade de teste. Por outro lado, se o programa de tratamento químico impedir a formação de incrustações na unidade de teste, pode-se presumir razoavelmente que o restante do sistema está limpo. Uma vantagem óbvia é que, se ocorrer incrustação, o tubo pode ser facilmente removido para análise de depósito. Uma chave para uma aplicação bem-sucedida desta tecnologia é uma pesquisa completa do sistema de resfriamento para garantir que as condições dentro da unidade de teste sejam mais graves do que qualquer um dos trocadores de calor do processo.
Monitoramento de corrosão
O método de monitoramento de corrosão mais fundamental é por cupons de corrosão. Os cupons devem ser dos mesmos metais que estão no sistema de resfriamento. Os cupons simularão as mesmas taxas de corrosão que os componentes do sistema, mas com a ressalva novamente de que eles não representam totalmente as condições nas superfícies do tubo ou da placa, especialmente em relação às influências da temperatura.
O cupom mais frequentemente empregado para monitoramento de corrosão da água de resfriamento é o C1010 (aço leve), mas outros materiais comuns incluem aço inoxidável (geralmente uma ou mais das séries 300), latão admiralty, cobre-níquel, alumínio, aço galvanizado e qualquer outra metalurgia que possa estar presente.
Cupons de corrosão novos, limpos e pré-pesados devem ser colocados em serviço por um mínimo de 30 dias, com períodos mais longos de 60, 90 e 120 dias também recomendados. Essa faixa fornece dados de corrosão de curto e longo prazo.
A aparência do cupom quando extraído pela primeira vez mostra o tipo e a quantidade de incrustação na superfície. Essa incrustação pode revelar várias quantidades de produtos de corrosão ou talvez outros detritos. Registros e fotografias após a remoção são importantes, pois materiais de deposição ou corrosão podem se deslocar durante o envio ao laboratório. Mesmo os odores, como sulfeto de hidrogênio, podem ser de valor na identificação de um mecanismo de incrustação. A inspeção visual inicial geralmente sugere um certo mecanismo de corrosão, mas a limpeza de cupons no laboratório e análises adicionais podem fornecer detalhes adicionais sobre os mecanismos de corrosão. Idealmente, é claro, os cupons permanecerão em condições quase perfeitas, o que significa a seleção e o desempenho adequados dos programas de tratamento químico.
A figura abaixo descreve um relatório de corrosão fundamental.
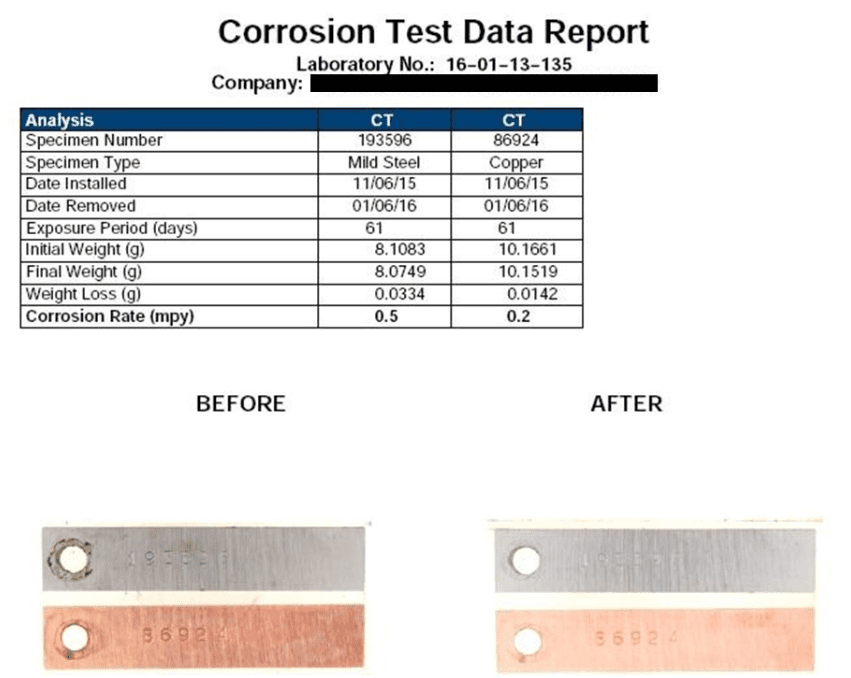
O relatório e as fotos ilustram um cupom de corrosão de aço neutro e cobre submetido ao ambiente de água de resfriamento por pouco mais de dois meses. Apenas corrosão geral muito leve foi detectada, com baixas taxas de corrosão de 0,5 e 0,2 mpy, respectivamente. Os resultados do cupom sugerem excelente controle de corrosão.
Projeto de amostragem de cupom de corrosão
A figura a seguir ilustra um arranjo comum de amostragem de corrosão, o “rack de desvio de cupom de corrosão” (rack de cupom). O material de tubulação mais comum para amostragem de água de resfriamento é o CPVC, mas a tubulação de aço pode ser necessária para sistemas de água quente ou pressurizada.

Uma característica primordial do design correto é a orientação do cupom. Como é evidente acima, a orientação é com o fluxo de água ao longo e não contra o cupom. Essa configuração ajuda a minimizar as correntes de Foucault. O suporte do cupom normalmente tem uma “marca de testemunha” na cabeça sextavada para garantir a orientação adequada.
O suporte do cupom é eletricamente inerte para evitar efeitos galvânicos. Em sistemas quentes com tubulação de metal, o parafuso e o parafuso devem ser da mesma metalurgia que o cupom, com conexões separadas por arruelas não metálicas.
A configuração de tubulação na Figura 7.85 mostra quatro posições potenciais de cupom. Este arranjo permite amostragem separada de 30, 60, 90 e 120 dias, ou qualquer outra frequência desejada, e com metais diferentes. É importante que diferentes metais sejam dispostos de acordo com a série galvânica, do mínimo ao mais nobre. Também importante com esses sistemas é a instalação de válvulas que permitem um bom controle do fluxo de amostra. Válvulas globo em vez de válvulas de gaveta são recomendadas.
Um debate frequentemente surge sobre o uso de cupons pré-tratados versus não tratados. Qualquer um pode produzir dados benéficos. Se a preocupação for determinar a eficácia com que as concentrações normais de inibidor na água a granel podem passivar o sistema, então os cupons não tratados são melhores. No entanto, se a preocupação for sobre o potencial de corrosão de curto prazo, como corrosão alveolar, então cupons pré-tratados podem ser melhores para que a corrosão flash inicial não mascare outros problemas.
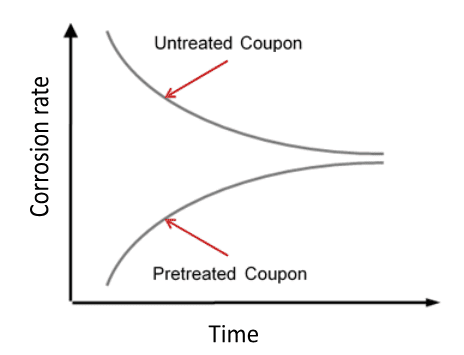
O cupom não tratado sofrerá uma corrosão rápida inicial, após a qual a taxa diminui à medida que o cupom se torna passivado. O cupom pré-tratado tem baixas taxas de corrosão inicial até que a película protetora inibidora atinja o equilíbrio com o sistema a granel, ponto em que o cupom imitará as condições no sistema de água. Durante um longo período de tempo (60 a 90 dias), as taxas de corrosão se aproximam umas das outras.
Medidores de taxa de corrosão on-line
Os medidores de corrosão estão disponíveis para medir a corrosão eletronicamente. As vantagens são medições instantâneas e contínuas. No entanto, eles são significativamente mais caros do que os cupons de corrosão.
Dois tipos principais de medidores de corrosão são comuns: resistência à polarização linear (LPR) e resistência elétrica (ER). Esta seção se concentra em LPR, que mede as leituras reais de militensão produzidas durante a corrosão.
Resistência à polarização linear
O instrumento pode ser equipado com eletrodos do metal de interesse, que então corroem pelos mecanismos normais.

A tecnologia é aplicável para água de resfriamento e outros sistemas de água, incluindo:
- Recuperação secundária de óleo
- Sistemas de tratamento e distribuição de água potável
- Tratamento de águas residuais
- Fabricação de papel e celulose
- Produção de hidrocarbonetos com água livre
Como as figuras indicam, as sondas de 2 e 3 eletrodos são comuns. Os medidores LPR podem medir instantaneamente as taxas de corrosão de 0,01 a 200 mils por ano (MPY) e a corrosão de 1,1 a 100 unidades de corrosão usando um fator de proporcionalidade que relaciona as características de polarização elétrica da sonda à sua taxa de corrosão.
Teste de corrosão no laboratório
Técnicas eletroquímicas, por exemplo, polarização cíclica, são comuns no laboratório para avaliar a suscetibilidade do material à corrosão localizada. Parâmetros críticos como potencial de corrosão, potencial de corrosão, corrente de corrosão e potenciais de repasse podem ser determinados a partir do experimento de polarização cíclica.
O esquema da configuração eletroquímica e os gráficos representativos de polarização cíclica são mostrados abaixo.
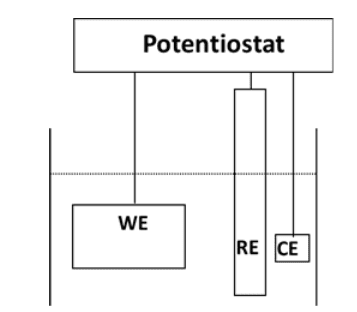
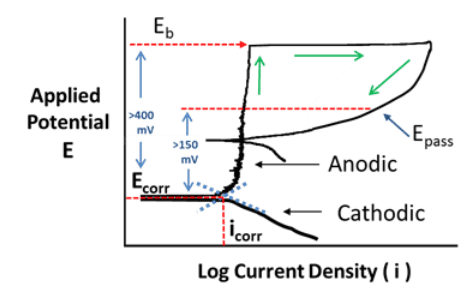
A partir dos gráficos de polarização cíclica, parâmetros importantes podem ser calculados como:
- Potencial de perfuração (Epit) = Eb – Ecorr | Eq. 7-32
- Potencial de repasse (ERP) = Epass – Ecorr | Eq. 7-33
Geralmente aceita-se que um valor de Epit superior a 350-400 mV acoplado a um ERP superior a 150 mV significa que há uma possibilidade mínima de corrosão localizada e que a liga é adequada para uso em longo prazo naquele ambiente.
A Figura 7.92 ilustra as curvas de polarização cíclica para uma amostra de aço inoxidável 304 em água de torneira de Richmond, Virgínia, a uma temperatura de 150°F e com a concentração de cloreto aumentada para 750 ppm. Vários parâmetros críticos de corrosão podem ser derivados deste gráfico e são mostrados na Tabela 7-4. Os dados descrevem a proteção contra corrosão fornecida pela química RPSI da ChemTreat.
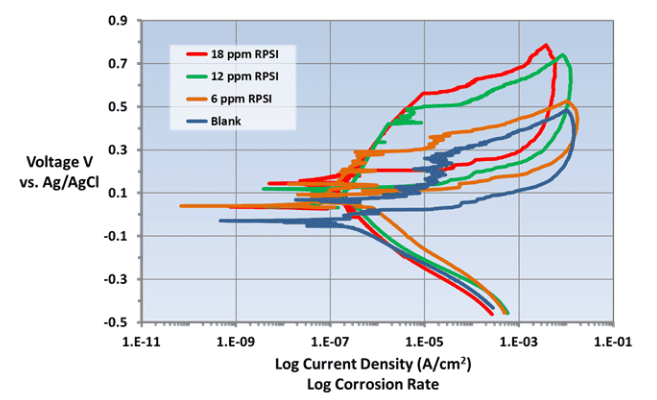
Tabela 7-4.
Vários parâmetros de corrosão calculados a partir das curvas de polarizações cíclicas mostradas na Figura 7.92.

É claro a partir desses dados que os potenciais de corrosão alveolar e repassivação aumentam com o aumento da dosagem de RPSI. 100 ppm de RPSI satisfaz a exigência de Epit maior que 400 mV e ERP maior que 150 mV e confirma que o Tipo 304 SS não sofre corrosão localizada nessas condições.
Também é bem conhecido que alguns aços, e particularmente o 304 e o 316 SS, podem sofrer de rachaduras por corrosão sob tensão (SCC) com concentrações normalmente baixas de cloreto, mas com temperatura crescente. A capacidade do RPSI de potencialmente proteger o 304 SS do SCC foi demonstrada em testes laboratoriais, nos quais amostras estressadas com dobra em U foram colocadas por 15 dias em um banho de água da torneira a 105 °C fortificada com 1.000 mg/L de cloreto. As figuras abaixo mostram a condição das amostras após o teste.

A amostra não tratada é claramente manchada e perfurada. O espécime exposto à mesma solução contendo o inibidor de corrosão RPSI não mostra evidência de mancha ou corrosão alveolar. Sob ampliação, a rachadura é claramente evidente na dobra da amostra não tratada, enquanto a amostra tratada não mostra rachaduras.
Limpeza e Passivação do Sistema de Resfriamento
Esta seção apresenta diretrizes gerais de passivação para sistemas de refrigeração. Muitas vezes, os engenheiros de projeto e o pessoal da fábrica veem as limpezas pré-operacionais e a passivação do sistema como itens menores ou desnecessários. Nesses casos, o procedimento pode consistir, no máximo, em encher o sistema com água, testes hidrostáticos (quando aplicável) e, em seguida, inicialização da unidade. Frequentemente, o fornecedor de tratamento de água é levado à discussão muito tarde para oferecer informações e conselhos sobre a criticidade da pré-limpeza e passivação adequadas. Esta discussão descreve as recomendações gerais para aplicações comuns, com o entendimento de que cada sistema de resfriamento tem características individuais e metalurgias. É necessário consultar especialistas em tratamento químico de boa reputação para desenvolver procedimentos precisos de limpeza e passivação.
Limpeza e passivação pré-operacionais
Os novos sistemas de resfriamento muitas vezes contêm detritos deixados para trás nas fases de construção e instalação, juntamente com resíduos de óleo e graxa e produtos de corrosão por ferrugem flash. É fundamental ter um plano de limpeza e passivação em vigor e executado antes do comissionamento real do sistema. A discussão a seguir é dividida em três categorias.
- Sistemas de recirculação abertos (sem componentes de aço galvanizado)
- Sistemas de recirculação abertos (aço galvanizado presente)
- Sistemas de resfriamento fechados com foco em resfriadores
Uma descrição muito mais detalhada dos procedimentos de limpeza, passivação e disposição está disponível na Referência 28.
Limpeza pré-operacional e passivação - Diretrizes gerais
Juntamente com lodo, sujeira, óleos e ferrugem, novas torres de resfriamento também podem acumular lodo orgânico e algas em reservatórios e decks que foram inundados para proteção contra incêndio. Esses organismos podem sujar e obstruir os tubos do condensador e do trocador de calor, o enchimento da torre de resfriamento e outros equipamentos.
Diretrizes gerais para todas as limpezas/passivação
Antes do início do procedimento de limpeza e passivação:
- Enxágue e lave todas as linhas, reservatórios e decks da torre com água limpa.
- Certifique-se de que todos os filtros, filtros, válvulas de reversão de fluxo e drenos estejam instalados e em plenas condições de operação.
- As bombas de alimentação de produtos químicos devem ser instaladas e estar operacionais; no entanto, os produtos químicos de limpeza e passivação podem ser alimentados manualmente, se necessário.
- Desconecte ou ignore todas as sondas de condutividade, pH e outras sondas analíticas para evitar incrustação e contaminação deste equipamento.
- Prepare uma lista de verificação abrangente e, em seguida, marque todas as válvulas de controle de fluxo, drenos e controladores. Certifique-se de que todos os equipamentos tenham as configurações corretas da válvula (geralmente totalmente aberta ou totalmente fechada) antes da limpeza. Os procedimentos escritos devem fornecer um guia para as posições da válvula e outras configurações durante cada estágio do processo.
- Os operadores da fábrica e/ou o pessoal de manutenção devem fazer parte de uma equipe dedicada para operar válvulas, filtros e filtros limpos, etc., durante todo o processo. Uma reunião de segurança e planejamento/revisão é necessária no início de cada turno durante o processo.
- Torres de resfriamento e outros equipamentos não devem ser submetidos a cargas de calor durante o processo.
Observação:Os arranjos de drenagem para esgoto, tanques de retenção ou outro descarte de resíduos de limpeza devem estar em vigor antes da limpeza. Embora essa água residual não seja normalmente perigosa, ela geralmente contém níveis inaceitáveis de sólidos e óleos suspensos. Além disso, o pH da descarga pode exceder os limites de NPDES ou POTW (trabalhos de tratamento de propriedade pública). Penalidades graves podem ser avaliadas se ocorrer descarga não autorizada e inadequada de águas residuais. Frequentemente, a solução de limpeza gasta pode ser enviada a um POTW se tiverem sido feitos arranjos anteriores.
Procedimentos de limpeza para torres não galvanizadas
As etapas de limpeza e passivação podem ser realizadas juntas ou em sucessão imediata. Na maioria dos casos, o sistema de torre de água é primeiro limpo e lavado e, em seguida, passivado com concentrações de inibidor fortes antes de colocar o sistema em operação. As etapas a seguir são comuns:
- Encha o reservatório da torre e as linhas até os níveis normais de operação e comece a recircular a água da torre em taxas normais (operacionais) de bombeamento.
- Trocadores de processo, resfriadores e/ou condensadores devem ser ignorados no lado do processo. Todas as entradas e saídas do lado da água devem estar totalmente abertas.
- Adicione produtos químicos inibidores após o início da circulação. Os produtos químicos podem ser bombeados, ou alimentados manualmente, no reservatório da torre ou injetados diretamente em qualquer coletor de água de retorno ou fornecimento principal.
Em geral, os produtos químicos empregados para limpeza inicial e passivação incluem agentes para manter um pH neutro ou levemente alcalino, surfactantes para remoção de óleo e graxa e um agente antiespumante. Um pirofosfato para manter um pH de 10 pode ser benéfico para passivação aumentada.
Após a adição dos produtos químicos, a água da torre deve circular em taxas normais de operação por quatro a oito horas para garantir a distribuição e limpeza adequadas. Os procedimentos aplicados corretamente produzirão aço passivado.
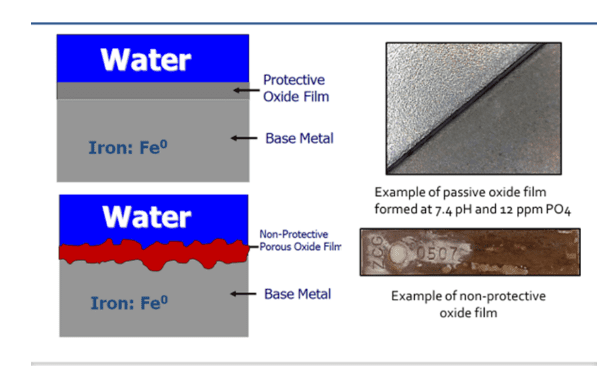
Na conclusão do processo, a torre, a tubulação do sistema de resfriamento e os trocadores de calor devem ser drenados e lavados o mais completamente possível para remover óleos, lodos e lodo biológico do sistema. Novamente, já devem estar em vigor acordos para descartar este efluente.
Se o sistema de resfriamento permanecer cheio, mas em espera por mais de três dias, recomenda-se a proteção com um biocida não oxidante. Comum é um produto isotiazolina livre de cobre. No mínimo, a água da torre deve circular por uma a duas horas semanais antes da partida, mas 1–2 horas por dia é ideal.
Recomendações de pré-tratamento, passivação e manutenção para torres de resfriamento galvanizadas e condensadores evaporativos
Para sistemas contendo componentes galvanizados, procedimentos especiais são necessários para garantir que os materiais galvanizados desenvolvam uma camada de passivação adequada. A tabela abaixo descreve as recomendações de três fabricantes de torres de resfriamento.
Tabela 7-5:
Valores e faixas recomendados para química da água dos fabricantes de equipamentos originais da torre de resfriamento galvanizada. Fonte: “White Rust Prevention – An Industry Update and Guide Paper – 2012”, Association of Water Technologies (AWT).
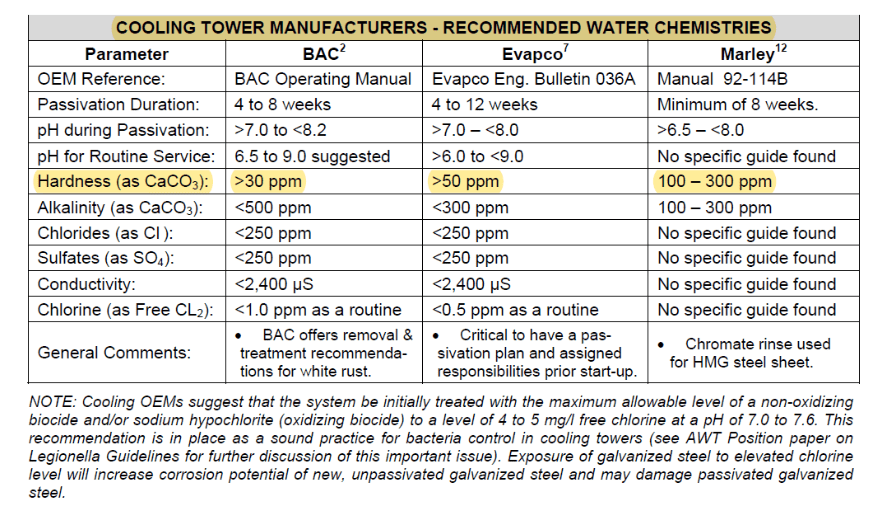
Observe que existe alguma variabilidade nas diretrizes químicas recomendadas, mas cada programa é projetado para produzir um composto de carbonato de zinco hidratado hermético na superfície do metal. Acredita-se que a fórmula química deste composto seja 3Zn (OH)2∙ZnCO3∙H2O.
Se esse condicionamento for omitido, ou se a operação subsequente elevar a água de resfriamento para um pH elevado, o zinco reagirá com a água para formar um hidróxido de zinco gelatinoso poroso, que então reage com o carbonato e converte o material em um depósito poroso branco conhecido como "ferrugem branca".

Se a ferrugem branca se desenvolver no metal galvanizado, os depósitos se tornam cada vez mais porosos com uma perda crescente de metal por baixo. Essa corrosão acabará expondo o aço carbono subjacente a ataques.
Uma vez que o revestimento passivo tenha sido adequadamente estabelecido, vários fabricantes de torres de resfriamento recomendam uma faixa operacional de pH normal de 6,5-9,0. Isso está dentro das diretrizes para as diretrizes comuns de controle de depósito e corrosão discutidas acima. Os recursos para mais informações incluem o Cooling Technology Institute e fabricantes específicos de torres de resfriamento.
Limpeza pré-operacional de um circuito fechado do resfriador
Após um desligamento prolongado ou uma nova instalação, a ferrugem do flash e as condições estagnadas podem ter um impacto dramático sobre as condições das redes de resfriadores. A falha em limpar e passivar adequadamente um sistema antes da inicialização pode resultar em falhas não planejadas repetidas. Se houver a oportunidade de tirar fotos das principais condições do equipamento antes e depois da limpeza, as imagens permitirão a avaliação da eficácia da limpeza. O conhecimento completo da metalurgia do sistema é essencial para a seleção dos produtos químicos de limpeza e passivação adequados. O aço carbono normalmente constitui a metalurgia do sistema primário, mas ligas de cobre e aço inoxidável também podem estar presentes. Se componentes de alumínio estiverem no sistema, são necessárias precauções especiais para proteger este metal.
Procedimento geral de pré-limpeza
- Estabeleça a circulação do sistema e lave o equipamento para remover detritos grandes na taxa de fluxo máxima possível. Encha o sistema até no máximo 80% do volume de projeto para permitir espaço para expansão térmica e adição de agente de limpeza. Não fornecer a expansão pode resultar em falhas do equipamento.
- Injete os produtos de limpeza/passivação. Eles consistem em detergentes alcalinos, surfactantes e tampões de pH para remover óleo, graxa e outros detritos e passivar os metais. Um azol pode ser incluído para passivação de liga de cobre. Circule a solução de limpeza através dos trocadores por 12–36 horas para remover produtos de corrosão, óleo e graxa e passivar todos os metais. Tenha produtos químicos antiespumantes disponíveis.
- Quando o período de circulação estiver concluído, drene o sistema para remover os produtos químicos de pré-limpeza, produtos de corrosão, incrustação de fábrica, sujeira, etc. Lave todas as válvulas e inspecione se há pernas mortas. (idealmente, as pernas mortas devem ser identificadas e eliminadas sempre que possível antes da limpeza, passivação e operação normal.)
- Adicione inibidores de corrosão apropriados e, possivelmente, um biocida não oxidante se o equipamento estiver em espera após o processo de limpeza/passivação.
O processo de limpeza/passivação é diferente para cada aplicação e pode ser muito específico para certas instalações, como centros de processamento de dados.
Arranjo do sistema de resfriamento
Em muitas instalações, o equipamento opera 24 horas por dia, 7 dias por semana, com pouco tempo de inatividade. No entanto, para os momentos em que os sistemas devem ser retirados da linha, procedimentos de preparação bem projetados e conduzidos são necessários para evitar corrosão grave. A combinação de água fria e oxigênio pode ser muito destrutiva para algumas ligas, mais notavelmente aço carbono. Além disso, os micro-organismos podem se depositar e se proliferar em água estagnada. Falhas subsequentes de tubos ou tubos do MIC foram bem documentadas.
Se possível, o equipamento de drenagem e secagem é frequentemente o melhor método para minimizar a corrosão. A circulação de ar desumidificado (DHA) pode ser muito eficaz para a secagem. Um exemplo desse processo é descrito no Capítulo 4 para proteção de turbinas a vapor durante interrupções. Muitas vezes, no entanto, a água deve permanecer parada nos sistemas para que possam ser iniciados em curto prazo. Nesses casos, várias etapas são recomendadas para a proteção do metal. Isso inclui:
- Tenha procedimentos de preparação bem desenvolvidos à mão e prontamente acessíveis ao pessoal da fábrica. Os detalhes nos procedimentos devem incluir:
- Concentrações de agentes passivantes e biocidas a serem estabelecidos na rede.
- Pontos de amostragem e frequência de testes para esses compostos
- Frequência, duração e taxas de fluxo da circulação de água (a circulação é muito importante para evitar a formação de água estagnada).
- Etapas para lavar os produtos químicos do sistema, se necessário, antes da partida da unidade.
- Métodos de descarte de águas residuais
- Diretrizes para inspeção de equipamentos. Isso deve incluir procedimentos de entrada em espaços confinados.
Conclusão
A química da água de resfriamento e a minimização da corrosão, incrustação e incrustação microbiológica são assuntos complexos. Muitos fatores influenciam esses fenômenos. Espera-se que este capítulo forneça informações úteis para proprietários de fábricas, operadores e pessoal técnico no desenvolvimento de programas eficazes de tratamento de água de resfriamento.
Encontre soluções personalizadas de tratamento de água com a ChemTreat
A ChemTreat está comprometida em fornecer soluções especializadas de tratamento de água. Nossas soluções inovadoras e personalizadas de tratamento de água ajudam a controlar corrosão, incrustação e bioincrustação em sistemas de resfriamento em uma variedade de setores. Entre em contato com a ChemTreat para entrar em contato com seu representante local e saber como a ChemTreat pode ajudar sua empresa hoje.
Referências
1. W.D. Callister, Jr., Ciência e engenharia de materiais: An Introduction, 3a Ed., John Wiley & Sons, 1994.
2. Correspondência por e-mail com Dan Janikowski da Plymouth Tube Company, janeiro 2022.
3. Post, R., e Kalakodimi, P., “The Development and Application of Non-Phosphorus Corrosion Inhibitors for Cooling Water Systems”; apresentado no Congresso Mundial de Energia, Atlanta, Geórgia, outubro 2017.
4. Fundamentos da corrosão: uma introdução. Associação Nacional de Engenheiros de Corrosão, Houston, TX, 1984.
5. Deacon, J. (sem data) The Microbial World: Thermophilic microorganisms , University of Edinburgh, School of Biological Sciences . Universidade de Edimburgo, Escola de Ciências Biológicas. Disponível em: http://archive.bio.ed.ac.uk/jdeacon/microbes/thermo.htm (acessado em: 22 de novembro de 2022).
6. J.W. McCoy, Microbiologia da água de resfriamento. Chemical Publishing Company, NY 1980, páginas 197–198.
7. Qual é a diferença entre bolor e levedura? – quora (sem data) Quora . Disponível em: https://www.quora.com/What-is-the-difference-between-mold-yeast (Acessado em: 1 de setembro de 2022).
8. Stewart, P.S., 1996. “Aspectos teóricos da difusão de antibióticos em biofilme microbiano”, agentes antimicrobianos e quimioterapia, novembro de 1996, p. 2517–2522.
9. Departamento de Saúde e Serviços Humanos dos EUA. (n.d.). Doença do legionário – sobre a doença. Centro de informações sobre doenças genéticas e raras. Disponível em 2021, em https://rarediseases.info.nih.gov/diseases/6876/legionnaires-disease/
10. T. Rowbotham “Relatório preliminar sobre a patogenicidade da Legionella pneumophila para água doce e amebaia do solo” J. Clin. Pathol. 1980, 33, 1179-1183.
11. J. B. Kurtz, C. L. R. Bartlett, U. A. Newton, R. A. White e N. L. Jones “Legionella in Cooling Water Systems” J. Hyg. Camb. 1982, 88, 369-381.
12. E. E. Sutherland e S. G. Berk “Sobrevivência de protozoários em biocidas de torres de resfriamento” J. Ind. Microbiol. 1996, 16, 73-78.
13. D. B. McIlwaine, J. Diemer, e S. Berk, “The Efficacy of Glutaraldeído Against Legionella Harboring Protozoa”, Corrosion 98, Paper No. 98521, (San Diego CA, NACE 1998)
14. Agência de Proteção Ambiental (n.d.). EPA: Sistema Nacional de Eliminação de Descarga de Poluentes (National Pollutant Discharge Elimination System, NPDES). 22 de novembro de 2022 recuperado, de https://www.epa.gov/npdes
15. Baron, C. D. “Novo oxidante leve melhorou o desempenho do tratamento da água de resfriamento em relação aos oxidantes tradicionais.” Instituto de Tecnologia de Resfriamento, março 2012
16. Baron, C. D. “Melhore o desempenho do sistema e reduza a corrosão do sistema usando um novo biocida para torres de resfriamento.” Instituto de Tecnologia de Resfriamento, fevereiro 2016
17. Nota técnica da Rohm and Haas Biocides, “Estequiometria do microbiocida KATHON WT 1,5% com bissulfito de sódio”.
18. Merianos, J. J. 1991. “Compostos antimicrobianos de amônio quaternário” em Block, S. S., Disinfection, Sterilization, and Preservation, 4th ed., Lea & Febiger, Philadelphia, pp. 225 – 255, e referências citadas neste documento.
19. Petrocci, A. N., Green, H. A., Merianos, J. J., e Like, B., 1974. “The Properties of Dialquil Dimethyl Quaternary Ammonium Compounds,” C. S. M. A. Proceedings of the 60th Mid Year Meeting, maio 1974, pp 87 – 89.
20. R. M. Post, K. Emery, G. Dombrowski, e M. Fagan, “Cleanively Cellular Plastic Cooling Tower Fill”; do 33o Workshop Anual de Química de Utilidades Elétricas, 11 de junho-13, 2013, Champaign, Illinois.
21. K. Boudreaux, “Usando biodetergentes para recuperar megawatts de forma econômica e com impacto ambiental mínimo”, Power Plant Chemistry, 2015, Vol 17(3), pp. 168 – 177.
22. R. D. Vidic. S. M. Duda, e J. E. Stout, “Biological Control in Cooling Water Systems Using Non-Chemical Treatment Devices”, ASHRAE Project Number 1361-RP , Final Technical Report, abril 2010.
23. J. E. Stout, S. M. Duda e R. D. Vidic, “Eficácia de dispositivos não químicos no controle de Legionella: Resultados de um sistema de resfriamento modelo” Cooling Technology Institute Paper No: TP11-08.
24. Khalanski, M. (1993). Teste de cinco métodos para o controle de mexilhões de zebra em circuitos de resfriamento de usinas de energia localizadas no Rio Moselle. Terceira Conferência Internacional de Mexilhões da Zebra, Toronto.
25. Matisoff, G., Brooks, G. e Bourland, I.B. (1996). Otimizar os processos de tratamento do dióxido de cloro para mexilhões adultos. J. A.W.W.A., agosto de 1996, páginas 93-106.
26. Roensch, F., “Controle de mexilhões e mariscos” ChemTreat Technical Bulletin #91, setembro 2004.
27. Elliott, P., “Recomendações de pré-tratamento, passivação e manutenção para torres de resfriamento galvanizadas ou condensadores evaporativos”, Boletim Técnico No 82 da ChemTreat, abril 2021.
Sobre os autores

Pete Elliott
Consultor sênior da equipe técnica
Pete Elliott é um especialista técnico confiável com mais de 30 anos de experiência em soluções de tratamento de água para sistemas de processamento térmico e de serviços públicos. Em sua linha de trabalho, Pete se concentra na produção de melhores práticas para operações eficientes da fábrica, conservação de energia e água e proteção e preservação de ativos. Ele publicou artigos técnicos para o Cooling Technologies Institute (CTI) e a Association of Water Technologies (AWT). Pete é bacharel em Engenharia Civil pela Villanova University e atuou como diretor de engenharia na Marinha dos Estados Unidos.

Rajendra P. Kalakodimi, PhD
Diretor de água de resfriamento
Rajendra P. Kalakodimi é diretora de água de resfriamento na ChemTreat. Ele obteve mestrado em física química na Universidade de Andhra e doutorado em eletroquímica no Instituto Indiano de Ciências em Bangalore em 2003. Enquanto estava na Índia, o Dr. Kalakodimi atuou como líder técnico de engenharia no GE India Technology Centre em Bangalore e como gerente de produtos químicos e soluções de monitoramento para a GE Water. Ele tem mais de 20 registros de patentes, 20 publicações internacionais e várias apresentações em conferências.

Richard H. Tribble
Consultor de serviços técnicos
Richard H. Tribble é formado pela Virginia Commonwealth University e está em tratamento de água há 26 anos. Ele desenvolveu uma infinidade de formulações de produtos de resfriamento de alto desempenho, tem seis patentes sob seu nome e é autor de vários artigos. Atualmente, ele trabalha como campeão de produtos de circuito fechado para a ChemTreat, além de ser especializado em análise de falhas de causa raiz.
Reconhecimentos
O Manual Water Essentials da ChemTreat não teria sido possível sem as contribuições de muitas pessoas. Veja a lista completa de colaboradores.
